
����Ŀ��ͼ��X��YΪ���ʣ�����Ϊ���������֮���������ת����ϵ�����ֲ�������ȥ�������У�A�׳ƴ�����������
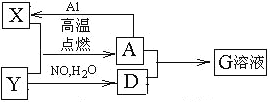
�ش��������⣺
��1��NaOH�д��ڵĻ�ѧ��������Ϊ_____________��
��2��д��Y![]() D �Ļ�ѧ����ʽ��________________��
D �Ļ�ѧ����ʽ��________________��
��3��д��A��D��ϡ��Һ��Ӧ����G�����ӷ���ʽ��________________��
��4����4mol D��ϡ��Һ�У�����X��ĩ���������������ɵ�����ֻ��һ�֣���������ϵ�л���n(X2+)��n(X)�仯��ʾ��ͼ�������n(X2+)�����ֵ_______��
���𰸡� ���Ӽ������Թ��ۼ� 4NO + 3O2 + 2H2O = 4HNO3 3Fe3O4+28H��+NO3��![]() 9Fe3��+NO��+14H2O
9Fe3��+NO��+14H2O 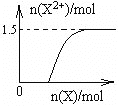
��������A�׳ƴ�������������AΪFe3O4����Al�������ȷ�Ӧ�����������͵�������X��YΪ���ʣ���XΪFe������������Ӧ����Fe3O4����YΪO2��DΪHNO3��G��ҺΪFe(NO3)3��Һ��
��1��. NaOH��������������������֮��������Ӽ�����ԭ������ԭ��֮����ڼ��Թ��ۼ����ʴ�Ϊ���Ӽ������Թ��ۼ���
��2��. NO��O2��ˮ��Ӧ����HNO3����ѧ����ʽΪ��4NO + 3O2 + 2H2O = 4HNO3���ʴ�Ϊ4NO + 3O2 + 2H2O = 4HNO3��
��3��. ���������������ᷴӦʱ����Ԫ�ر�������+3�ۣ������е�Ԫ�ر���ԭ��+2�ۣ����ݵ�ʧ�����غ��ԭ���غ�����ӷ���ʽΪ��3Fe3O4+28H��+NO3��![]() 9Fe3��+NO��+14H2O���ʴ�Ϊ��3Fe3O4+28H��+NO3��
9Fe3��+NO��+14H2O���ʴ�Ϊ��3Fe3O4+28H��+NO3��![]() 9Fe3��+NO��+14H2O��
9Fe3��+NO��+14H2O��
��4��.�����������ᷴӦ��ʵ�ʣ���ʼʱ��ȫ������������Ϊ���������ʿ�ʼ��Fe2+����Ϊ0���������ļ��룬��������ֺ�Fe3+��Ӧ����Fe2+����Fe2+������������ֱ���ﵽ���ֵ��Ȼ���ٱ仯����Ӧ���������ɵ�����ΪNO����Fe2+��������ʵ���Ϊxmol������ת�Ƶ����غ��֪��NO�����ʵ���Ϊxmol��2/3������Nԭ���غ��֪��xmol��2/3+2xmol=4mol�����x=1.5����n(Fe2+)��n(Fe)�仯��ʾ��ͼΪ��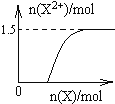 ���ʴ�Ϊ��
���ʴ�Ϊ�� 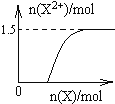 ��
��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ȼ�����һ��ʳ�����ϣ���ṹ��ʽ��ͼ�����ڸ��л������������ȷ���ǣ� ��
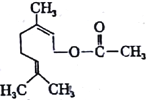
��1mol���л��������3molH2���ڲ��ܷ���������Ӧ���۷���ʽΪC12H20O2��������ͬ���칹���п����з��ࣻ��1mol���л���ˮ��ʱֻ������1molNaOH
A. �ڢۢ� B. �٢ܢ� C. �٢ڢ� D. �ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ڳ��³�ѹ�£� ��2CH3OH��l��+2O2��g���T2CO��g��+4H2O��g����H=��a kJmol��1
��2CO��g��+O2��g���T2CO2��g����H=��b kJmol��1
��H2O��g���TH2O��l����H=��c kJmol��1
���ʾCH3OH��l��ȼ���ȵ��Ȼ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ����Ũ��Ϊ1mol/L�ģ�NH4��2SO4����NH4��2CO3����NH4��2Fe(SO4)2����Һ�У�����c(NH4+)�ֱ�Ϊa��b��c(��λΪmol/L)�������ж���ȷ����
A. a=b=c B. a>b>c C. a>c>b D. c>a>b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ڷ�������ԭ��Ӧ�����Ƿ��ȷ�Ӧ���ǣ� ��
A.п����ϡ����ķ�Ӧ
B.����кͷ�Ӧ
C.�����������е�ȼ�շ�Ӧ
D.Ba(OH)2��8H2O������NH4Cl����ķ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)����֮��Ϊ16��7��6����������SO2��CO��NO�����Ӹ���֮��Ϊ________����ԭ�Ӹ���֮��Ϊ____________����ͬ���������֮��Ϊ________��
(2)ij����������Ļ�ѧʽΪRO2���ڱ�״���£�0.92 g ������������Ϊ448 mL������������Ħ������Ϊ________��R�����ԭ������Ϊ________��RO2�Ļ�ѧʽΪ______��
(3)�����£���27.5 gˮ���ܽ�12.5 g CuSO4��5H2O��ǡ�ôﵽ���ͣ�����Һ���ܶ�Ϊ1.60 g/cm3�������Һ��CuSO4�����ʵ���Ũ��Ϊ____________������ȡ��20.0 mL����Һ�����Ũ��Ϊ1.00 mol/L��ϡ��Һ����ϡ�ͺ���Һ�������________mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ú�������л���������ӽ��в��Բ���¼���ɳ����жϸ��л������ӵ�еģ�������
A.ͬ���칹����
B.ԭ�Ӹ���
C.��������
D.���ۼ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����11�֣�Ϊ��̽��Cl2��SO2ͬʱͨ��H2O�����ķ�Ӧ��ijУ��ѧ��ȤС��ͬѧ���������ͼ��ʾ��ʵ��װ�á�
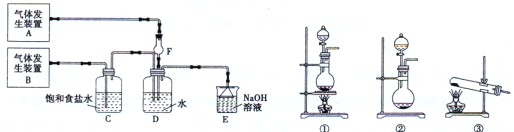
����գ�
��1���û�ѧ��ȤС���ͬѧΪ��ȡCl2��SO2���壬�ֲ���Na2SO3��70%��Ũ����Ϊԭ����ȡSO2������MnO2��Ũ���ᣨ12 mol��L-1��Ϊԭ����ȡCl2���ڴ�ʵ���У�F������������ �����巢��װ��BӦѡ����������������װ���е� ��ѡ����ţ���
��2��Dװ������Ҫ��Ӧ�����ӷ���ʽΪ�� ��
��3��Ϊ��֤ͨ��Dװ����������Cl2��������SO2��������ȤС���ͬ!ѧ���������Լ����Ȼ�����Һ���Ȼ�������Һ�����軯����Һ��������Һ��Ʒ����Һ�����Ը��������Һ��
��Cl2����ȡ����D����Һ�μ���ʢ�� ���Լ����ƣ���ͬ�����Թ��У��ټ�������������� ��˵��Cl2������
��SO2������ȡ����D����Һ�μ���ʢ�� ���Թ��ڣ������������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ���������ֵ��������˵����ȷ���ǣ� ��
A. 0.1mol��L-1��NaHSO4��Һ�к��������ӵ����ʵ���Ϊ0.2mol
B. �ڱ�״̬�£�11.2 L NO��11.2 L O2��Ϻ����������Ϊ0.75NA
C. ��1molFeCl3�ı�����Һ�����ˮ�еõ�������������������ĿΪNA
D. 106 g Na2CO3�����е���������ΪNA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com