
【题目】NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如下:
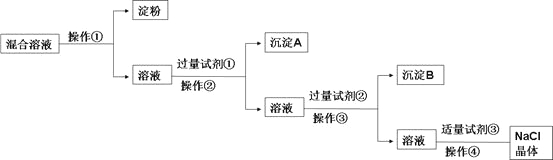
(1)写出上述实验过程中所用试剂(写化学式):
试剂①___________________;试剂③________________。
(2)判断试剂①已过量的方法是:________________________。
(3)用化学方程式表示加入试剂②的作用:_______________________。
(4)操作①是利用半透膜进行分离提纯。
操作①的实验结果:淀粉_____________(填“能”或“不能”)透过半透膜;SO42-_____________(填“能”或“不能”)透过半透膜;请用实验证明上述结果,完成下表(可不填满,也可增加):限选试剂:1mol/L AgNO3溶液、1mol/L BaCl2溶液、1mol/L Ba(NO3)2溶液、碘水、稀盐酸、稀硝酸
编号 | 实验操作 | 预期现象和结论 |
① | ||
② |
【答案】
(1)BaCl2;HCl
(2)静置,向上层清液屮滴加少量稀H2SO4溶液,没有白色沉淀产生,说明氧化钡溶液已过量。
(3)Ba2++CO32-=BaCO3↓ Ca2++CO32-=CaCO3↓
(4)不能:能
填表
编号 | 实验操作 | 预期现象和结论 |
① | 取半透膜外液体,加入少量碘水 | 液体没有变成蓝色,证明淀粉不能透过半透膜 |
② | 另取半透膜外液体,加入足量稀盐酸和少量1mol/LBaCl2溶液 | 产生不溶于盐酸的白色沉淀,证明SO42-能够透过半进膜 |
【解析】
试题分析:胶体不能透过半透膜,操作①为渗析,除去Na2SO4、CaCl2,可分别加入BaCl2、Na2CO3,除去粗盐中含有的Ca2+、SO42-可溶性杂质的方法:加入过量BaCl2,去除硫酸根离子;再加入过量Na2CO3(去除钙离子),则试剂①为BaCl2,操作②为过滤,沉淀A为硫酸钡,试剂②为Na2CO3,操作③为过滤,沉淀B为碳酸钙和碳酸钡,试剂③为盐酸,加入盐酸可除去过量的Na2CO3,最后蒸发结晶可得到NaCl晶体。
(1)由以上分析可知试剂①为BaCl2,试剂③为HCl,故答案为:BaCl2;HCl;
(2)判断试剂①已过量的方法是静置,向上层清液中滴加少量氯化钡溶液,没有白色沉淀产生,说明氯化钡溶液已过量,故答案为:静置,向上层清液中滴加少量氯化钡溶液,没有白色沉淀产生,说明氯化钡溶液已过量;
(3)试剂②为Na2CO3,加入试剂②的作用是除去溶液中钙离子和过量的钡离子,反应的化学方程式为BaCl2+Na2CO3=2NaCl+BaCO3↓、CaCl2+Na2CO3=2NaCl+CaCO3↓,故答案为:BaCl2+Na2CO3=2NaCl+BaCO3↓、CaCl2+Na2CO3=2NaCl+CaCO3↓;
(4)胶体粒子和浊液粒子半径比较大,不能透过半透膜,而溶质粒子可通过半透膜,检验淀粉,可取半透膜外液体,加入少量碘水,液体没有变成蓝色,证明淀粉不能透过半透膜,检验SO42-,可另取半透膜外液体,加入足量稀盐酸和少量1mol/L BaCl2溶液,产生不溶于盐酸的白色沉淀,证明SO42-能够透过半透膜。故答案为:不能;能;
编号 | 实验操作 | 预期现象和结论 |
① | 取半透膜外液体,加入少量碘水 | 液体没有变成蓝色,证明淀粉不能透过半透膜 |
② | 另取半透膜外液体,加入足量稀盐酸和少量1mol/LBaCl2溶液 | 产生不溶于盐酸的白色沉淀,证明SO42-/span>能够透过半进膜 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠的工艺流程如下:
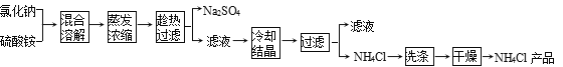
【查阅资料】
①上述流程所示物质中只有NH4Cl受热易分解:NH4Cl![]() NH3↑+HCl↑
NH3↑+HCl↑
②氯化铵和硫酸钠的溶解度随温度变化曲线如下图所示:
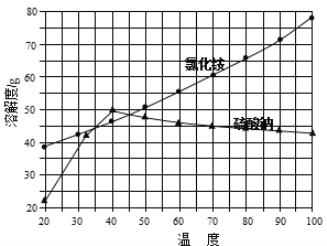
请回答下列问题:
(1)写出氯化钠和硫酸铵溶液混合得到硫酸钠晶体的化学方程式: 。
(2)欲制备10.7 g NH4Cl,理论上需NaCl质量为 g。
(3)实验室进行蒸发结晶用到的主要仪器除铁架台、铁圈、酒精灯外,还要有 。
(4)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为 。
(5)不用其它试剂,检查NH4Cl产品是否纯净的方法:
操作步骤 | 现象 | 结论 |
取少量氯化铵产品于试管底部, | 表明氯化铵产品纯净 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学变化属于加成反应的是
A.乙醇在铜作催化剂的条件下加热和空气的反应
B.乙烯通入溴的四氯化碳溶液中的反应
C.甲烷在光照条件下与氯气发生的反应
D.苯与液溴在铁粉作催化剂的条件下发生的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化尿素是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素:反应的方程式为:
CO(NH2)2+H2O2![]() CO(NH)2·H2O2。过氧化尿素的部分性质如下:
CO(NH)2·H2O2。过氧化尿素的部分性质如下:
合成过氧化尿素的流程及反应装置图如下:
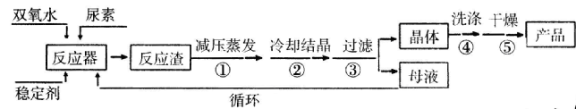
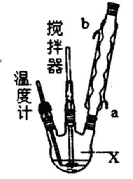
请回答下列问题:
(1)仪器X的名称是____________;冷凝管中冷却水从____________(填“a”或“b”)口进入。
(2)反应器的加热方式是_______________。
(3)搅拌器是否可用铁质材料___________(填“是”或“否”),原因是_______________。
(4)步骤① 采用减压蒸发的原因是___________。
(5)下列选项中,最适合作为步骤④ 的洗涤液是_______。
a.冰水 b.热水 c.饱和NaCl溶液 d.酒精和水的混合液
(6)准确称取0.5000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加1mL 6mol/L H2SO4,用0.1000 mol/L KMnO4标准溶液滴定至终点时消耗20.00mL(尿素与KMnO4溶液不反应)。
① 滴定终点的现象是______________。
② 则产品中CO(NH)2·H2O2的质量分数为______________。
③ 若滴定前仰视,滴定后俯视,则测得的过氧化尿素含量_________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验及显色结果的叙述,错误的是
A.水浴加热条件下,麦芽糖与斐林试剂发生反应生成砖红色沉淀
B.蛋白质溶液遇双缩脲试剂变紫色
C.人的口腔上皮细胞经健那绿染色后,可以看到呈蓝绿色的线粒体
D.常温条件下,脱氧核糖核酸与吡罗红作用呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列说法正确的是( )
A.盐卤可用于制作豆腐
B.从海水中提取物质都要通过化学反应才能实现
C.煤经过气化和液化等物理变化可转化为清洁燃料
D.制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含有Al2O3、SiO2和少量FeOxFe2O3的铝灰制备Al2(SO4)318H2O,工艺流程如下:
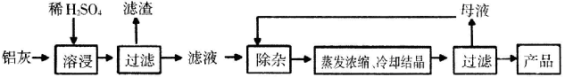
(一定条件下,MnO4-可与Mn2+反应生成MnO2)
已知:生成氢氧化物沉淀的PH

(1)H2SO4溶解Al2O3的离子方程式是____________。
(2)检验滤液中还存在Fe2+的方法是______________。
(3)“除杂”环节有如下几个步骤:(I)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2 (II)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;(Ⅲ)加入MnSO4至紫红色消失,过滤。
①步骤I 的目的是:_________;调节溶液的pH为3.2的目的是__________。
②向步骤II的沉淀中加入浓HCl并加热,有黄绿色气体生成,写出其反应方程式______。
③步骤Ⅲ中加入MnSO4的目的是__________(用离子反应方程式表示)
(4)从多次循环使用后母液中可回收的主要物质是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是重要的资源,可以制备一系列物质,
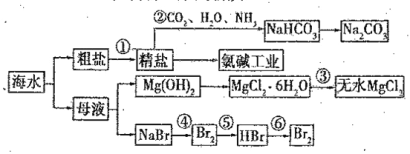
下列说法正确的是( )
A.步骤②中,应先通CO2 ,再通NH3
B.步骤③可将MgCl2·6H2O晶体在空气中直接加热脱水
C.步骤④、⑤、⑥反应中,溴元素均被氧化
D.除去粗盐中的 SO42-、Ca2+ 、Mg2+ 等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2 溶液→Na2CO3 溶液→过滤→盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关四位同学进行物质鉴定实验的叙述中正确的是
A. 张同学直接用碘液来检测苹果汁中的葡萄糖
B. 李同学用苏丹Ⅳ染液鉴定金龙鱼调和油中的脂昉
C. 王同学用西瓜汁代替梨汁进行还原糖鉴定实验
D. 赵同学用甲基绿鉴定蓝藻细胞核中的DNA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com