
����Ŀ���ú���Al2O3��SiO2������FeOxFe2O3�������Ʊ�Al2��SO4��318H2O����������������
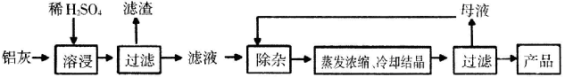
��һ�������£�MnO4-����Mn2����Ӧ����MnO2)
��֪�������������������PH

��1��H2SO4�ܽ�Al2O3�����ӷ���ʽ��____________��
��2��������Һ�л�����Fe2+�ķ�����______________��
��3�������������������¼������裺��I������Һ�м������KMnO4��Һ��������Һ��pHΪ3.2 ��II�����ȣ�����������ɫ���������ã��ϲ���Һ���Ϻ�ɫ��(��������MnSO4���Ϻ�ɫ��ʧ�����ˡ�
������I ��Ŀ���ǣ�_________��������Һ��pHΪ3.2��Ŀ����__________��
������II�ij����м���ŨHCl�����ȣ��л���ɫ�������ɣ�д���䷴Ӧ����ʽ______��
���������м���MnSO4��Ŀ����__________�������ӷ�Ӧ����ʽ��ʾ��
��4���Ӷ��ѭ��ʹ�ú�ĸҺ�пɻ��յ���Ҫ������________���ѧʽ����
���𰸡���1��Al2O3��6H����2Al3����3H2O
��2��ȡ������Һ���Թܣ��μ�����KMnO4��Һ��KMnO4��Һ��ɫ����˵����Fe2����
��3������Fe2+����ΪFe3+������pHֵʹ����ȫ������
��MnO2��4HCl![]() MnCl2��Cl2����2H2O
MnCl2��Cl2����2H2O
��Mn2����MnO4����2H2O��MnO2��4H��
��4��K2SO4��
��������
�����������1�������ܽ�������������������ˮ����Ӧ�����ӷ���ʽΪ��Al2O3 + 6H+ = 2Al3+ + 3H2O����2������KMnO4��Һ��Fe2+��Ӧ��MnO4-����ԭ��Mn2+����Һ��ɫ����3��������Һ�м������KMnO4��Һ��Ŀ����Fe2+����ΪFe3+������ͼ�����ݷ�����֪��Fe3+��ʼ�����ͳ�����ȫ����ҺpHΪ1.5��2.8��Al3+��Fe2+��ʼ��������ҺpH����3�����Ե�����Һ��pHԼΪ3������ʹFe3+ȫ��������Al3+������,�ﵽ���룻��һ�������£�MnO4������Mn2+��Ӧ����MnO2.�����ij����м���ŨHCl�����ȣ�MnO2 + 4HCl��Ũ��== MnCl2 + Cl2��+ 2H2O����MnO4������Mn2+��Ӧ����MnO2�����˳�ȥ�����Կ�������MnSO4��Һ��KMnO4��Һ��Ӧ����MnO2���ѹ���MnO4����ȥ��


 �̲�ȫ���ִʾ�ƪϵ�д�
�̲�ȫ���ִʾ�ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������������¹ʵĴ�����������ȷ����( )
A.��ʢ��Һ�����ƿ����ʱ����Ҫ�����Ƭ���ʯ
B.����ʵ�������д����Ŀ�ȼ������й©ʱ��Ӧ��������ͨ��
C.�ƾ����ڵľƾ����ܳ����ƾ����ݻ���2/3
D.����������Ũ���ὦ��Ƥ���ϣ�Ӧ������ˮ��ϴ��Ȼ��ͿĨ10%��NaOH��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ǧ(PbCrO4)�׳Ƹ��ƣ�������ˮ���㷺����Ϳ�ϡ���ī��������Ϻ��Ľ���Ʒ�ȹ�ҵ��ʵ����ģ�ҵ���ø�����(����Cr2O3��Fe2O3��Al2O3��SiO2��)�Ʊ����ƵĹ����������£�
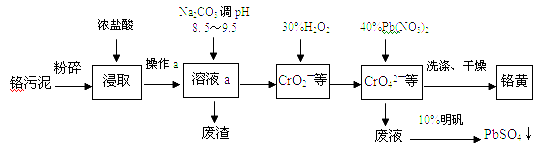
��1�������У����Ļ��ϼ�Ϊ ��
��2���ڽ�ȡ������Ũ������Fe2O3�����ӷ���ʽ ������a������Ϊ
��3��д������30%H2O2�����з��������ӷ�Ӧ����ʽ
��4���ڷ�Һ�м���10%������Һ������Ӧ�����ӷ���ʽΪ
��5���Ժ�����ˮ���д����ķ����ǣ�����Cr2O72�������Է�ˮ��������ڣ������������������������Ȼ��ƽ��е�⡣���������ɵ�Fe2+��Cr2O72��������Ӧ�����ɵ�Fe3+��Cr3+����������OH���������Fe(OH)3��Cr(OH)3������ȥ��
��д��Fe2+��Cr2O72��������Ӧ�����ӷ���ʽ
����������������ҺpH����������ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaCl��Һ�л���Na2SO4��CaCl2��Һ�͵��۽��壬ѡ���ʵ����Լ��ͷ��������ᴿ��NaCl���塣��Ӧ��ʵ��������£�
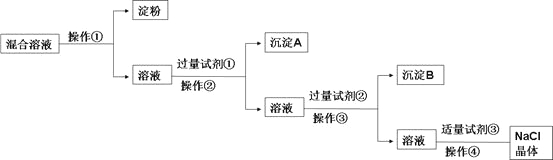
��1��д������ʵ������������Լ�(д��ѧʽ����
�Լ���___________________���Լ���________________��
��2���ж��Լ����ѹ����ķ����ǣ�________________________��
��3���û�ѧ����ʽ��ʾ�����Լ��������ã�_______________________��
��4�������������ð�Ĥ���з����ᴿ��
��������ʵ����������_____________(������������������������Ĥ��SO42-_____________(������������������������Ĥ������ʵ��֤���������������±�(�ɲ�������Ҳ������������ѡ�Լ���1mol/L AgNO3��Һ��1mol/L BaCl2��Һ��1mol/L Ba(NO3��2��Һ����ˮ��ϡ���ᡢϡ����
��� | ʵ����� | Ԥ������ͽ��� |
�� | ||
�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л����˵���У�����ȷ���ǣ� ��
A��Һ��ʯ��������Ȼ������Ҫ�ɷֶ��Ǽ�Ժ
B�������Ҵ������ᶼ�ܷ���ȡ����Ӧ
C����֬�ڼ�Ĵ������¿ɷ���ˮ�⣬��ҵ�����ø÷�Ӧ��������
D��ú�������ǻ�ѧ�仯��ʯ�ͷ����������仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ�����������в���ȷ���ǣ� ��
��12.4g�������к��е�P��P����Լ��0.6NA��
�ڵ�⾫��ͭʱת����NA�����ӣ������ܽ�32gͭ��
��7.8g Na2S��Na2O2�Ļ�����к��е�������������0.1NA��
��2mol SO2��1mol O2�����V2O5���ڵ����������ܱ������м��ȷ�Ӧ�����������ʷ���������2NA��
��2.9g 2CaSO4H2O���еĽᾧˮ������Ϊ0.02NA ��2CaSO4H2Oʽ��Ϊ290����
��1molFeCl3���ˮ��Ӧ���ɽ������NA��Fe��OH��3������
�ߺ�0.1mol����Na2CO3����Һ�У�������������������0.1NA��
A���٢ڢۢܢݢ� B���ڢۢݢ� C���٢ۢܢݢ� D���ۢܢݢޢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£����ݻ�Ϊ2 L���ܱ�������ͨ���������巢����ѧ��Ӧ����Ӧ�и����ʵ����ʵ����仯����ͼ��ʾ���Ը÷�Ӧ���ƶϺ�������( )
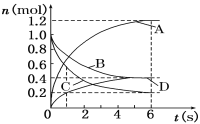
A���÷�Ӧ�Ļ�ѧ����ʽΪ3B��4D ![]() 6A��2C
6A��2C
B����Ӧ���е�1 sʱ��v(A)��v(D)
C����Ӧ���е�6 sʱ��B��ƽ����Ӧ����Ϊ0.05 mol/(L��s)
D����Ӧ���е�6 sʱ�������ʵķ�Ӧ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Һ��ϡ���ᷴӦ�Ļ�ѧ����ʽΪ�� Na2S203+H2S04=Na2S04+S02+S��+H20�����и���ʵ�������ȳ��ֻ��ǵ��ǣ� ��
ʵ�� | ��Ӧ������ | Na2SO4 | Na2S2O3 ��Һ | ϡ H2SO4 | H2O | |
V/mL | c/ (moL-L-1) | V/mL | d (moL-L-1) | V/mL | ||
A | 25 | 5 �� | 0.1 | 10 | 0.1 | 5 |
B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л����˵���У�����ȷ���ǣ� ��
A�������Ҵ������ᶼ�ܷ���ȡ����Ӧ
B��Һ��ʯ��������Ȼ������Ҫ�ɷֶ��Ǽ���
C����֬�ڼ�Ĵ������¿ɷ���ˮ�⣬��ҵ�����ø÷�Ӧ��������
D�������Ƶ�Cu(OH)2����Һ�ɼ�����Һ�е�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com