
【题目】过量的碳排放会引起严重的温室效应,导致海洋升温、海水酸化,全球出现大规模珊瑚礁破坏,保护珊瑚礁刻不容缓。
(1)海水中含有的离子主要有Na+、Mg2+、Ca2+、K+、Cl–、CO32–和HCO3–。其中,导致海水呈弱碱性的微粒有______。
(2)珊瑚礁是珊瑚虫在生长过程中吸收海水中物质而逐渐形成的石灰石外壳。形成珊瑚礁的主要反应为Ca2+ + 2HCO3- ![]() CaCO3↓+ CO2↑+ H2O。
CaCO3↓+ CO2↑+ H2O。
① 请结合化学用语分析该反应能够发生的原因:______。
② 与珊瑚虫共生的藻类通过光合作用促进了珊瑚礁的形成;而海洋温度升高会使共生藻类离开珊瑚礁,导致珊瑚礁被破坏。请分析珊瑚礁的形成和破坏会受到共生藻类影响的原因:______。
(3)研究人员提出了一种封存大气中二氧化碳的思路:将二氧化碳和大量的水注入地下深层的玄武岩(主要成分为CaSiO3)中,使其转化为碳酸盐晶体。玄武岩转化为碳酸盐的化学方程式为______。
(4)“尾气CO2直接矿化磷石膏联产工艺”涉及低浓度CO2减排和工业固废磷石膏处理两大工业环保技术领域,其部分工艺流程如下图所示。
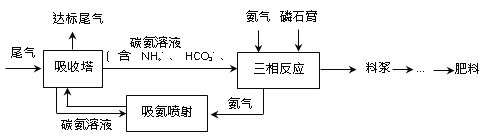
已知:磷石膏是在磷酸生产中用硫酸处理磷矿时产生的固体废渣,其主要成分为CaSO4·2H2O。
①吸收塔中发生的反应可能有______(写出任意2个反应的离子方程式)。
②料浆的主要成分是______(写化学式)。
【答案】CO32-、HCO3- HCO3-在海水中存在电离平衡:HCO3-![]() CO32- + H+,当c(Ca2+)与c(CO32-)的乘积大于Ksp(CaCO3)时,Ca2+与CO32-生成CaCO3沉淀;使HCO3-电离平衡正向移动,c(H+)增大,H+与HCO3-进一步作用生成CO2 共生藻类存在,会通过光合作用吸收CO2,使平衡:Ca2+ + 2HCO3-
CO32- + H+,当c(Ca2+)与c(CO32-)的乘积大于Ksp(CaCO3)时,Ca2+与CO32-生成CaCO3沉淀;使HCO3-电离平衡正向移动,c(H+)增大,H+与HCO3-进一步作用生成CO2 共生藻类存在,会通过光合作用吸收CO2,使平衡:Ca2+ + 2HCO3-![]() CaCO3↓+ CO2↑+ H2O正向移动,促进珊瑚礁的形成;共生藻类死亡,使海水中CO2的浓度增大,使上述平衡逆向移动,抑制珊瑚礁的形成 CaSiO3 + CO2 + H2O=CaCO3 + H2SiO3(或CaSiO3 + CO2=CaCO3 + SiO2) NH3·H2O + CO2=2NH4+ + CO32- + H2O、NH3·H2O + CO2=NH4+ + HCO3-、CO32- + CO2 + H2O=2HCO3-(写出任意2个均可) CaCO3、(NH4)2SO4
CaCO3↓+ CO2↑+ H2O正向移动,促进珊瑚礁的形成;共生藻类死亡,使海水中CO2的浓度增大,使上述平衡逆向移动,抑制珊瑚礁的形成 CaSiO3 + CO2 + H2O=CaCO3 + H2SiO3(或CaSiO3 + CO2=CaCO3 + SiO2) NH3·H2O + CO2=2NH4+ + CO32- + H2O、NH3·H2O + CO2=NH4+ + HCO3-、CO32- + CO2 + H2O=2HCO3-(写出任意2个均可) CaCO3、(NH4)2SO4
【解析】
(1)根据盐类水解的规律分析判断;
(2)①HCO3-在海水中存在电离平衡:HCO3-![]() CO32- + H+,当c(Ca2+)与c(CO32-)的乘积大于Ksp(CaCO3)时生成CaCO3沉淀;常见HCO3-电离平衡正向移动,c(H+)增大,H+与HCO3-进一步作用生成CO2,据此分析解答;②结合光合作用和Ca2+ + 2HCO3-
CO32- + H+,当c(Ca2+)与c(CO32-)的乘积大于Ksp(CaCO3)时生成CaCO3沉淀;常见HCO3-电离平衡正向移动,c(H+)增大,H+与HCO3-进一步作用生成CO2,据此分析解答;②结合光合作用和Ca2+ + 2HCO3-![]() CaCO3↓+ CO2↑+ H2O的平衡移动分析解答;
CaCO3↓+ CO2↑+ H2O的平衡移动分析解答;
(3)根据沉淀的转化书写反应的方程式;
(4)①二氧化碳和氨气发生反应可能生成碳酸氢铵,也可能生成碳酸铵,据此书写反应的离子方程式;②碳氨溶液中的HCO3-与氨气生成CO32-、CO32-和磷石膏(主要成分为CaSO4·2H2O)发生沉淀的转化,据此分析判断。
(1)在Na+、Mg2+、Ca2+、K+、Cl–、CO32–和HCO3–微粒中,CO32-、HCO3-水解生成氢氧根离子,导致海水呈弱碱性,故答案为:CO32-、HCO3-;
(2)①HCO3-在海水中存在电离平衡:HCO3-![]() CO32- + H+,当c(Ca2+)与c(CO32-)的乘积大于Ksp(CaCO3)时,Ca2+与CO32-生成CaCO3沉淀;使HCO3-电离平衡正向移动,c(H+)增大,H+与HCO3-进一步作用生成CO2,总反应为Ca2+ + 2HCO3-
CO32- + H+,当c(Ca2+)与c(CO32-)的乘积大于Ksp(CaCO3)时,Ca2+与CO32-生成CaCO3沉淀;使HCO3-电离平衡正向移动,c(H+)增大,H+与HCO3-进一步作用生成CO2,总反应为Ca2+ + 2HCO3- ![]() CaCO3↓+ CO2↑+ H2O,故答案为:HCO3-在海水中存在电离平衡:HCO3-
CaCO3↓+ CO2↑+ H2O,故答案为:HCO3-在海水中存在电离平衡:HCO3-![]() CO32- + H+,当c(Ca2+)与c(CO32-)的乘积大于Ksp(CaCO3)时,Ca2+与CO32-生成CaCO3沉淀;使HCO3-电离平衡正向移动,c(H+)增大,H+与HCO3-
CO32- + H+,当c(Ca2+)与c(CO32-)的乘积大于Ksp(CaCO3)时,Ca2+与CO32-生成CaCO3沉淀;使HCO3-电离平衡正向移动,c(H+)增大,H+与HCO3-
②共生藻类存在,会通过光合作用吸收CO2,使平衡:Ca2+ + 2HCO3-![]() CaCO3↓+ CO2↑+ H2O正向移动,促进珊瑚礁的形成;共生藻类死亡,使海水中CO2的浓度增大,使上述平衡逆向移动,抑制珊瑚礁的形成,因此与珊瑚虫共生的藻类通过光合作用促进了珊瑚礁的形成;而海洋温度升高会使共生藻类离开珊瑚礁,导致珊瑚礁被破坏,故答案为:共生藻类存在,会通过光合作用吸收CO2,使平衡:Ca2+ + 2HCO3-
CaCO3↓+ CO2↑+ H2O正向移动,促进珊瑚礁的形成;共生藻类死亡,使海水中CO2的浓度增大,使上述平衡逆向移动,抑制珊瑚礁的形成,因此与珊瑚虫共生的藻类通过光合作用促进了珊瑚礁的形成;而海洋温度升高会使共生藻类离开珊瑚礁,导致珊瑚礁被破坏,故答案为:共生藻类存在,会通过光合作用吸收CO2,使平衡:Ca2+ + 2HCO3-![]() CaCO3↓+ CO2↑+ H2O正向移动,促进珊瑚礁的形成;共生藻类死亡,使海水中CO2的浓度增大,使上述平衡逆向移动,抑制珊瑚礁的形成;
CaCO3↓+ CO2↑+ H2O正向移动,促进珊瑚礁的形成;共生藻类死亡,使海水中CO2的浓度增大,使上述平衡逆向移动,抑制珊瑚礁的形成;
(3)将二氧化碳和大量的水注入地下深层的玄武岩(主要成分为CaSiO3)中,使其转化为碳酸盐晶体,反应的化学方程式为CaSiO3 + CO2 + H2O = CaCO3 + H2SiO3,故答案为:CaSiO3 + CO2 + H2O = CaCO3 + H2SiO3;
(4)①根据流程图,吸收塔中吸收了尾气中的二氧化碳和进入吸收塔的氨气发生反应生成了碳氨溶液,反应的方程式可能有NH3·H2O + CO2 = 2NH4+ + CO32- + H2O、NH3·H2O + CO2 =NH4+ + HCO3-、CO32- + CO2 + H2O =2HCO3-,故答案为:NH3·H2O + CO2 = 2NH4+ + CO32- + H2O、NH3·H2O + CO2 =NH4+ + HCO3-、CO32- + CO2 + H2O =2HCO3-;
②碳氨溶液(含NH4+、HCO3-)、氨气、和磷石膏(主要成分为CaSO4·2H2O)发生三相反应,HCO3-与氨气反应生成CO32-和NH4+,CO32-与CaSO4·2H2O反应生成碳酸钙沉淀和硫酸根离子,因此料浆的主要成分有CaCO3、(NH4)2SO4,故答案为:CaCO3、(NH4)2SO4。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】从海水提取镁和溴的流程如图,请回答相关问题。
(1)从海水中提取镁的流程如图所示(框图中是主要产物):
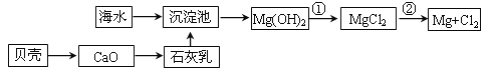
i.反应①的离子方程是_____;
ii.反应②的化学方程式是_____。
(2)从海水中提取溴的流程如图所示(框图中是主要产物):
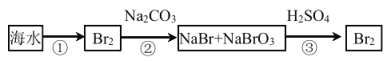
i.过程②中,向混合液中吹入热空气,将溴吹出,用纯碱吸收,吹入热空气的目的是______。
ii.过程③中反应的化学方程式是______。
iii.若最终得到的溴单质中仍然混有少量的Cl2,则除去该杂质的方法是______。(结合离子方程式回答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修2:化学与技术]聚合硫酸铁(PFS)是水处理中重要的絮凝剂,下图是以回收废铁屑为原料制备PFS的一种工艺流程。
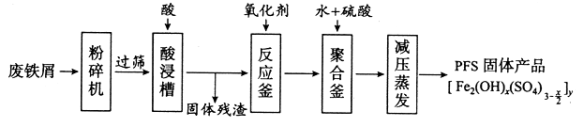
回答下列问题
(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为_________。粉碎过筛的目的是_______。
(2)酸浸时最合适的酸是_____,写出铁锈与酸反应的离子方程式_____________________。
(3)反应釜中加入氧化剂的作用是_________,下列氧化剂中最合适的是____________(填标号)。
a.KMnO4b.![]() c.
c.![]() d.
d.![]()
(4)聚合釜中溶液的pH必须控制在一定的范围内。pH偏小时Fe3+水解程度弱,pH偏大时则_______。
(5)相对于常压蒸发,减压蒸发的优点是______。
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,定义式为![]() (n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c
(n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c![]() 的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液V mL。按照上述步骤做空白对照试验,消耗NaOH溶液
的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液V mL。按照上述步骤做空白对照试验,消耗NaOH溶液![]() ,已知该样品中Fe的质量分数w,则B的表达式为__________。
,已知该样品中Fe的质量分数w,则B的表达式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将NO(g)和O2(g)按物质的量之比2∶1充入反应容器,发生反应:2NO(g) + O2(g) ![]() 2NO2(g)。其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线如下图所示。下列说法正确的是
2NO2(g)。其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线如下图所示。下列说法正确的是

A. p1 < p2
B. 其他条件不变,温度升高,该反应的反应限度增大
C. 400℃、p1条件下,O2的平衡转化率为20%
D. 400℃时,该反应的化学平衡常数的数值为10/9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2O3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________。该反应需要在加压下进行,原因是________。
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+![]() O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。
(4)298 K时,将20 mL 3x mol·L1 Na3AsO3、20 mL 3x mol·L1 I2和20 mL NaOH溶液混合,发生反应:AsO33(aq)+I2(aq)+2OH![]() AsO43(aq)+2I(aq)+ H2O(l)。溶液中c(AsO43)与反应时间(t)的关系如图所示。
AsO43(aq)+2I(aq)+ H2O(l)。溶液中c(AsO43)与反应时间(t)的关系如图所示。

①下列可判断反应达到平衡的是__________(填标号)。
a.溶液的pH不再变化
b.v(I)=2v(AsO33)
c. c (AsO43)/c (AsO33)不再变化
d. c(I)=y mol·L1
②tm时,v正_____ v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____ tn时v逆(填“大于”“小于”或“等于”),理由是_____________。
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为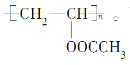 下列叙述正确的是
下列叙述正确的是
A. 1 mol该有机物与NaOH溶液完全反应时,消耗1 mol NaOH
B. 该有机物可通过加聚反应生成
C. 该有机物水解所得的产物能发生加成反应
D. 该有机物分子的单体为两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对两种有机物甲和乙的描述不正确的是( )
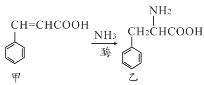
A.甲中所有碳原子不可能在同一平面上
B.甲、乙均能发生加成反应、氧化反应、取代反应
C.甲、乙均能在一定条件下通过聚合反应生成高聚物
D.甲、乙苯环上的一硝基取代物种数相同(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验某加碘食盐中是否含有KIO3,取相同食盐样品进行下表所示实验:
(已知:KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O)
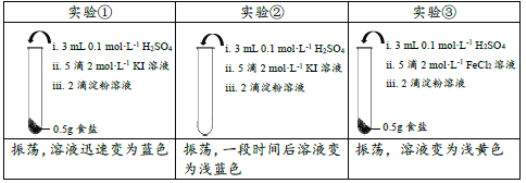
下列说法中不正确的是( )
A.仅由实验①不能证明食盐样品中存在KIO3
B.实验②中发生反应的离子方程式为4I-+O2+4H+=2I2+2H2O
C.实验③溶液变黄色是生成了Fe3+,证明食盐样品中存在KIO3
D.结合实验①和②的现象差异,可以推断实验样品中存在KIO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com