
【题目】[化学——选修2:化学与技术]聚合硫酸铁(PFS)是水处理中重要的絮凝剂,下图是以回收废铁屑为原料制备PFS的一种工艺流程。
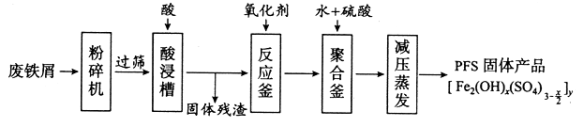
回答下列问题
(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为_________。粉碎过筛的目的是_______。
(2)酸浸时最合适的酸是_____,写出铁锈与酸反应的离子方程式_____________________。
(3)反应釜中加入氧化剂的作用是_________,下列氧化剂中最合适的是____________(填标号)。
a.KMnO4b.![]() c.
c.![]() d.
d.![]()
(4)聚合釜中溶液的pH必须控制在一定的范围内。pH偏小时Fe3+水解程度弱,pH偏大时则_______。
(5)相对于常压蒸发,减压蒸发的优点是______。
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,定义式为![]() (n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c
(n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c![]() 的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液V mL。按照上述步骤做空白对照试验,消耗NaOH溶液
的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液V mL。按照上述步骤做空白对照试验,消耗NaOH溶液![]() ,已知该样品中Fe的质量分数w,则B的表达式为__________。
,已知该样品中Fe的质量分数w,则B的表达式为__________。
【答案】(1)Fe2O3·xH2O 选取细小颗粒,增大反应物接触面积,提高“酸浸”反应速率(2)硫酸 Fe2O3·xH2O+6H+=2Fe3++(x+3)H2O
(3)使Fe从+2价变成+3价 c (4)pH过大,容易生成Fe(OH)3沉淀,产率降低
(5)降低蒸发温度,防止产物分解(6)![]()
【解析】
试题分析:(1)铁锈的主要成分为Fe2O3·xH2O。粉碎过筛的目的是控制铁屑的颗粒。
(2)由于不能引入杂质,则酸浸时最合适的酸是硫酸,铁锈与酸反应的离子方程式为Fe2O3·xH2O+6H+=2Fe3++(x+3)H2O。
(3)由于溶液中含有亚铁离子,则反应釜中加入氧化剂的作用是氧化Fe2+,由于不能引入杂质,则氧化剂中最合适的是绿色氧化剂双氧水。
(4)聚合釜中溶液的pH必须控制在一定的范围内,pH偏小时![]() 水解程度弱,pH偏大时则Fe3+转化为氢氧化铁沉淀而损失,造成产率降低。
水解程度弱,pH偏大时则Fe3+转化为氢氧化铁沉淀而损失,造成产率降低。
(5)相对于常压蒸发,减压蒸发的优点是可防止温度过高,聚合硫酸铁分解。
(6)做空白对照试验,消耗NaOH溶液![]() ,这说明与样品反应的盐酸的物质的量是(V0-V)c×10-3mol,所以样品中氢氧根的物质的量是(V0-V)c×10-3mol。已知该样品中Fe的质量分数w,则铁的物质的量是
,这说明与样品反应的盐酸的物质的量是(V0-V)c×10-3mol,所以样品中氢氧根的物质的量是(V0-V)c×10-3mol。已知该样品中Fe的质量分数w,则铁的物质的量是![]() ,因此B的表达式为
,因此B的表达式为![]() =
=![]() 。
。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)由乙烯制取聚乙烯的化学方程:_______________。
(2)写出下列物质的结构简式;
①2,3-二甲基戊烷____________________________________
②3-甲基-2-戊烯___________________________________
③间二甲苯____________________________
(3)分子中含有5个碳原子的链状单炔烃的分子式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验验证元素周期律。
(Ⅰ)甲同学在a、b、c三只烧杯里分别加入50 mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂、钠、钾块,观察现象。
甲同学设计实验的目的是 , 烧杯 (填字母)中的反应最剧烈。
(Ⅱ)乙同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强。他设计了下图装置以验证氮、碳、硅元素的非金属性强弱。
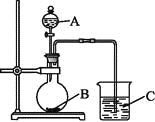
乙同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到有白色沉淀生成。
(1)写出所选用物质的化学式:A: ;B: ; C: 。
(2)写出烧杯中发生反应的离子方程式:
(3)该装置存在着某个缺陷,改进的方法是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,所列的字母分别代表一种元素。
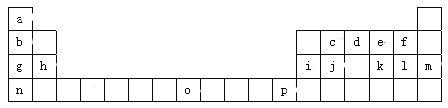
试回答下列问题:(填写时用对应元素符号或物质的化学式)
(1)f、g、l的简单离子的半径由小到大的顺序是 。
(2)原子Zn位于周期表中的 区,元素o在周期表中的位置是 ,元素o的二价阳离子的核外电子排布式是 。
(3)根据下表所示原子逐级电离能的数据分析并回答
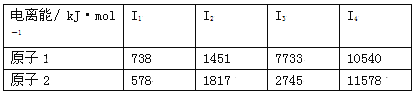
原子2对应周期表的元素是 ,原子1的第一电离能高于原子2的原因是 。
(4)周期表中所示各原子对应最高价氧化物的水化物碱性最强的是 (填水化物的化学式,下同),酸性最强的是 。写出碱性最强的水化物与Al(OH)3反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:_______与盐酸反应最剧烈,______与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理_______说明理由:_____________________________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。
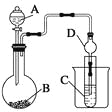
(3)仪器A的名称为____,干燥管D的作用是______________。
(4) 实验验证氯的非金属性大于硫:A中放浓盐酸、B中放KMnO4、C中盛放__________,离子方程式为____________。从环境保护的观点考虑,此装置缺少尾气处理装置,可用________溶液吸收尾气.
(5)若要证明非金属性:C>Si,则A中加盐酸、B中加Na2CO3、C中加________,观察到C中溶液的现象为____________________。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有________溶液的洗气瓶.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1) NaClO2的化学名称为_______。
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________。增加压强,NO的转化率______(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______ (填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。

①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”、“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为___________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______。
②已知下列反应:
SO2(g)+2OH (aq) ===SO32 (aq)+H2O(l) ΔH1
ClO (aq)+SO32 (aq) ===SO42 (aq)+Cl (aq) ΔH2
CaSO4(s) ===Ca2+(aq)+SO42(aq)ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq) === CaSO4(s) +H2O(l) +Cl (aq)的ΔH=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应:
①氢氧化钠与硫酸,②一氧化碳与氧气,③八水合氢氧化钡与氯化铵,④金属铜与硝酸银。
(1)属于复分解反应的放热反应的是____________________________。(用序号填空)
(2)属于吸热反应的是_____________________________________________。(用序号填空)
(3)能设计成原电池的反应是_______________________________________。(用序号填空)
(4)能设计成燃料电池的反应是_____________________________________。(用序号填空)
(5) 写出③发生反应的化学方程式___________________________________。
写出④发生反应的离子方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H = —49.0kJ/mo1.测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H = —49.0kJ/mo1.测得CO2和CH3OH(g)的浓度随时间变化如图所示。
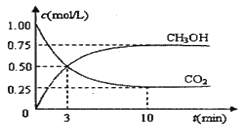
(1)从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)
(2)该反应的平衡常数为 。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入lmol CO2和3mol H2
(4)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) △H= —1275.6kJ/mol
②H2O(g)=H2O(1) △H= —44.0kJ/mol
则甲醇的燃烧热化学方程式为: ;
(5)如果燃烧甲醇会造成大量化学能损失,如果以甲醇和空气为原料,以氢氧化钠为电解质溶液设计成原电池将有很多优点,请书写出该电池的负极反应:___________________
(6)常温下,某水溶液M中存在的离子有:Na+、A—、H+、OH—。若该溶液M由 pH=3的HA溶液![]() mL与pH=11的NaOH溶液
mL与pH=11的NaOH溶液![]() mL混合反应而得,则下列说法中正确的是 __。
mL混合反应而得,则下列说法中正确的是 __。
A.若溶液M呈中性,则溶液M中c(H+)+c(OH—)=2×10—7mol·L-1
B.若V1=V2,则溶液M的pH一定等于7
C.若溶液M呈酸性,则V1一定大于V2
D.若溶液M呈碱性,则V1一定小于V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是

A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高
C. M–空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
D. 在Mg–空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com