
| A. | 该溶液中:c2(H+)≠c(H+)•c(A-)+Kw | |
| B. | 由pH=3的HA溶液与pH=11的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1 mol•L-1的HA和NaA溶液等体积混合,所得溶液中:c(A-)>c(HA)>c(Na+)>c(OH-)>c(H+) | |
| D. | 0.1 mol•L-1 HA溶液与0.05 mol•L-1 NaOH溶液等体积混合,所得溶液中:2c(H+)+c(HA)═c(A-)+2c(OH-) |
分析 A、在HA溶液中,氢离子来自于HA和水的电离,而氢氧根全部来自于水的电离;
B、HA为弱酸,故pH=3的HA溶液与pH=11的NaOH溶液等体积混合后,HA过量,据此分析离子浓度关系;
C、浓度均为0.1 mol•L-1的HA和NaA溶液等体积混合后,根据电离大于水解可知,溶液显酸性;
D、0.1 mol•L-1 HA溶液与0.05 mol•L-1 NaOH溶液等体积混合后,所得的为等浓度的NaA和HA的混合溶液,根据电荷守恒和物料守恒来分析.
解答 解:A、在HA溶液中,氢离子来自于HA和水的电离,而HA电离出的氢离子和A-浓度相等,水电离出的氢离子和氢氧根的浓度相等,故有溶液中的c(H+)=c(A-)+c(OH-),将式子两端同乘以c(H+),则有:c2(H+)=c(H+)•c(A-)+c(H+)•c(OH-),即有:c2(H+)=c(H+)•c(A-)+Kw,故A错误;
B、HA为弱酸,故pH=3的HA溶液与pH=11的NaOH溶液等体积混合后,HA过量,显酸性,故有:c(H+)>c(OH-),则有:c(Na+)<c(A-),故离子浓度关系为:c(A-)>c(Na+)>c(H+)>c(OH-),故B错误;
C、浓度均为0.1 mol•L-1的HA和NaA溶液等体积混合后,根据电离大于水解可知,溶液显酸性,且c(A-)>c(Na+)>c(HA),即离子浓度关系为:c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-),故C错误;
D、0.1 mol•L-1 HA溶液与0.05 mol•L-1 NaOH溶液等体积混合后,所得的为等浓度的NaA和HA的混合溶液,根据电荷守恒可知:c(H+)+c(Na+)=c(A-)+c(OH-),根据物料守恒可知:2c(Na+)=c(HA)+c(A-),将两式联立可知:2c(H+)+c(HA)═c(A-)+2c(OH-),故D正确.
故选D.
点评 本题考查了弱电解质的电离平衡和酸碱混合后所得溶液中的离子浓度大小关系的比较,综合性较强,难度中等,注意三个守恒的运用.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:推断题
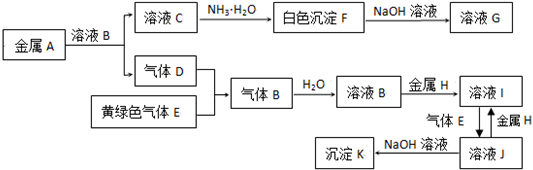
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 +Br2→BrCH2CH2CH2CH2CH2Br
+Br2→BrCH2CH2CH2CH2CH2Br
| A. | 环烷烃与烷烃都是饱和烃,所以具有相同的通式 | |
| B. | B所有的饱和烃都不能发生加成反应 | |
| C. | 可用溴水鉴别丙烯与环丙烷 | |
| D. | 可用酸性高锰酸钾溶液鉴别丙烯与环丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由2H和18O所组成水22g,其中所含的中子数为11NA | |
| B. | 分子数为NA的N2、CO混合气体体积为22.4L,质量为28g | |
| C. | 标准状况下,22.4LNO和11.2LO2混合后气体的原子总数为3NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,丙的电子式为
,丙的电子式为 ;E在周期表中的位置为第三周期VA族;
;E在周期表中的位置为第三周期VA族;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物对应水化物碱性强弱:A>C | |
| B. | D、E是铝土矿的主要成分 | |
| C. | B、E的最高价氧化物具有相似的物理性质和化学性质 | |
| D. | B、C、D、E的氧化物都是离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com