
����Ŀ��25��ʱ��H2SO3�������ε���Һ�У�H2SO3��HSO3-��SO32-�����ʵ�������(��)����ҺpH�仯��ϵ����ͼ��ʾ����������������ǣ� ��
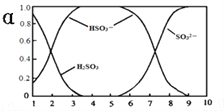
A. ��Һ��pH=5ʱ����Ԫ�ص���Ҫ������ʽΪHSO3-
B. ����Һǡ�ó�����ʱ��c(Na+)>c(SO32-)+c(HSO3-)
C. ��pH=8��������Һ�еμ���������ʯ��ˮ��![]() ��ֵ����
��ֵ����
D. ��pH=3��������Һ�еμ�����ϡ����,��(HSO3-)��С
���𰸡�C
��������A��pH=5ʱ��HSO3-�����ʵ�������(��)Ϊ1.0��˵����Ԫ�ص���Ҫ������ʽΪHSO3-����A��ȷ��B��c(H+)+c(Na+)=2c(SO32-)+c(HSO3-)+c(OH-)�����ԣ�c(Na+)��c(SO32-)+c(HSO3-)����B��ȷ��C����pH����c(SO32-)����c(HSO3-)��С������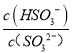 ��ֵ��С����C����D������ͼ����pH=3��������Һ�еμ�����ϡ���ᣬ��Һ��pH��С����(HSO3-)��С����(H2SO3)����D��ȷ����ѡC��
��ֵ��С����C����D������ͼ����pH=3��������Һ�еμ�����ϡ���ᣬ��Һ��pH��С����(HSO3-)��С����(H2SO3)����D��ȷ����ѡC��


 Сѧ��ĩ���100��ϵ�д�
Сѧ��ĩ���100��ϵ�д� ��ĩ��ϰ���ϵ�д�
��ĩ��ϰ���ϵ�д� ����ѧ�䵥Ԫ������ĩר����100��ϵ�д�
����ѧ�䵥Ԫ������ĩר����100��ϵ�д� �Ƹ�360�ȶ����ܾ�ϵ�д�
�Ƹ�360�ȶ����ܾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����㻯�����ڴ���������±��������ȡ����Ӧ��ΪFriedel-Crafts�������Ӧ��ij����С���Ա����ȴ��嶡��[ClC(CH3)3]Ϊ��Ӧ���ˮAlCl3Ϊ�����������Ʊ��嶡����(![]() )��
)��
��Ӧ����: +ClC(CH3)3
+ClC(CH3)3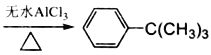 +HCl
+HCl
��֪������Ϣ:
���� | ��Է������� | �ܶ� | �۵� | �е� | �ܽ��� |
AlCl3 | ���� | ���� | 190�� | 180�� | ��ˮ���׳��Ⲣ������ɫ���������ڱ� |
�� | 78 | 0.88g/cm3 | ���� | 80.1�� | ������ˮ���������Ҵ� |
�ȴ��嶡�� | 92.5 | 1.84 g/cm3 | ���� | 51.6�� | ������ˮ�������ڱ� |
�嶡���� | 134 | 0.87 g/cm3 | ���� | 169�� | ������ˮ�������ڱ� |
I������ͼ��ʵ�����Ʊ���ˮAlCl3��ʵ��װ��:
(1)Eװ���е�����������_______________��
(2)д��Bװ���з�����Ӧ�����ӷ���ʽ:________________________��
(3)ѡ����ʵ�װ���Ʊ���ˮAlCl3��ȷ������˳��Ϊ:_____________ (д���ܿڱ��)��
(4)���в�����ȷ����________��
��:�ȼ���Ӳ�ʲ������ټ���Բ����ƿ
��:�ȼ���Բ����ƿ�ټ���Ӳ�ʲ�����
(5)Eװ�õ�������:_______________________��
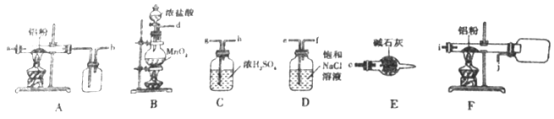
p>II��ʵ������ȡ�嶡����װ����ͼ: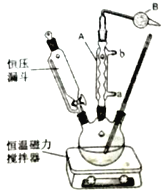
��������ƿ�м���50mL�ı�����������ˮAlCl3���ɺ�ѹ©���μ��ȴ��嶡��[ClC(CH3)3]10mL��һ���¶��·�Ӧһ��ʱ�����Ӧ��Ļ����ϴ�ӷ��룬�����ò����м���������ˮMgSO4���壬���ã����ˣ�������嶡����20g��
(6)ʹ�ú�ѹ©�����ŵ���____________________������ˮMgSO4�����������___________��
(7)������Ӧ�������ϴ�����õ��Լ����������֣���ȷ��˳����_____________��
��5%Na2CO3��Һ ��ϡ���� ��H2O
(8)�嶡�����IJ���Ϊ______��(����3λ��Ч����)
���𰸡� ����� MnO2+4H++2C1-=Mn2++Cl2��+2H2O d��e��f��g��h��i��j��c �� ��ֹ�����е�ˮ�������룬�����ն�������� ʹҺ��˳������ ���� �ڢ٢� 75.0%
��������I.(1). Eװ���е����������Ǹ���ܣ��ʴ�Ϊ������ܣ�
(2). ��Bװ������Ũ�����MnO2��Ӧ�����Ȼ��̡�������ˮ�����ӷ���ʽΪ��MnO2+4H++2Cl=Mn2++Cl2��+2H2O���ʴ�Ϊ��MnO2+4H++2Cl=Mn2++Cl2��+2H2O��
(3). Bװ�ò����������л����Ȼ����ˮ�������ʣ���Dװ�ó�ȥHCl ������Cװ�ó�ȥˮ�������ʣ������Ȼ������������������Ȼ����������������ܣ����Եõ���������������Fװ���к�����Ӧ��ȡ�Ȼ���������Aװ�ã�������Ϣ��֪�Ȼ�����ˮ���׳��Ⲣ������ɫ������������������Eװ�����ն�������������Է�ֹ�����е�ˮ��������Fװ���У�����Ʊ���ˮ�Ȼ�����ȷ������˳��Ϊd��e��f��g��h��i��j��c���ʴ�Ϊ��d��e��f��g��h��i��j��c��
(4). �Ʊ���ˮ�Ȼ���ʱ��Ӧ�ȼ���Բ����ƿ������������װ���еĿ����ž����Է�ֹ���۱������е������������ʴ�Ϊ���ң�
(5). ������������֪����Eװ�ÿ������ն�����������ܷ�ֹ�����е�ˮ��������Fװ����ʹ�Ȼ������⣬�ʴ�Ϊ����ֹ�����е�ˮ�������룬�����ն����������
II. (6). ʹ�ú�ѹ©������ƽ��©������ѹǿ��ʹҺ��˳�����£���ϴ�Ӻ����ò����м���������ˮMgSO4������Ŀ�������ղ�Ʒ��������ˮ�֣���������ã��ʴ�Ϊ��ʹҺ��˳�����£����
(7). ϡ����ϴ�ӿ��Գ�ȥ�Ȼ������ʣ�����5%Na2CO3��Һ��ȥ���������ᣬ�����ˮϴ�ӳ�ȥʣ���5%Na2CO3���ʴ�Ϊ���ڢ٢ۣ�
(8).���뱽�����ʵ���Ϊ50mL��0.88g/mL��78g/mol=0.56mol���ȴ��嶡������ʵ���Ϊ10mL��1.84g/mL��92.5g/mol=0.199mol���ɷ�Ӧ����ʽ +ClC(CH3)3
+ClC(CH3)3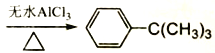 +HCl��֪������ı��������������������嶡����������Ϊ��0.199mol��134g/mol=26.66g���嶡�����IJ���Ϊ��
+HCl��֪������ı��������������������嶡����������Ϊ��0.199mol��134g/mol=26.66g���嶡�����IJ���Ϊ��![]() ��100%=75.0%���ʴ�Ϊ��75.0%��
��100%=75.0%���ʴ�Ϊ��75.0%��
�����͡�ʵ����
��������
9
����Ŀ��һ�ֺ�����ﮡ��ܵ����͵��Ӳ��ϣ������в����ķ��������ɹۣ������е����Խ�����������ʽ���ڣ�����Co2O3��CoO����ʽ���ڣ������������ĵ����˫�棺﮻��������С�(��֪Co2O3��������>Cl2��������)�ӷ����л���������(CoO)�Ĺ����������£�
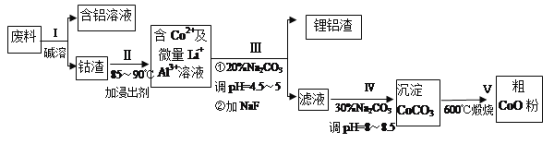
��֪����CoCO3���ܶȻ�Ϊ��Ksp=1.0��10-13��
����Һ������Ũ��С��1.0��10-5mol/Lʱ��Ϊ�����ӳ�����ȫ��
(1)�����ܡ�ǰͨ�������Ϸ��飬��Ŀ����____________��
(2)����I�в���NaOH��Һ�ܳ������е�A1����Ӧ�����ӷ���ʽΪ_________________��
(3)���̢��м���ϡH2SO4�ữ���ټ���Na2S2O3��Һ�����ܡ�������������ʵķ�Ӧ��ѧ����ʽΪ (������ֻ��һ�����) _______________________________________����ʵ����ģ�ҵ����ʱ��Ҳ������������ܣ���ʵ�ʹ�ҵ�����в������ᣬ�����������������ܵ���Ҫԭ��______________________________________��
(4)����III�õ����������Ҫ�ɷ���LiF��AI(OH)3��̼������Һ�ڲ��� Al(OH)3ʱ����Ҫ���ã���д���÷�Ӧ�����ӷ���ʽ__________________________________��
(5)��2.0��10-4 mol/LCoSO4��2.2��10-4mol/L��Na2CO3�������ϣ���ʱ��Һ�е�Co2+��Ũ��Ϊ__________��Co2+�Ƿ������ȫ? __________(��ǡ���)��
(6)CoO��������ɵ÷ۺ�ɫ��CoCl2��Һ��CoCl2���ᾧˮ��Ŀ��ͬ�����ֲ�ͬ��ɫ��������ɫ����ˮCoCl2��ˮ��ɫ��һ���ʿ��Ƴɱ�ɫˮ�������īˮ����ͼ�Ƿۺ�ɫ��CoCl2��6H2O�������ȷֽ�ʱ��ʣ������������¶ȱ仯�����ߣ�����B�Ļ�ѧʽ��____________________��
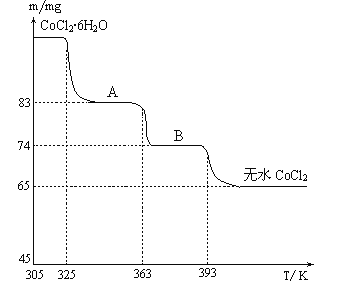
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С���ù�ҵ����(��Ҫ��MgCO3��FeCO3��Al2O3��)����þ�Ĺ�����������:
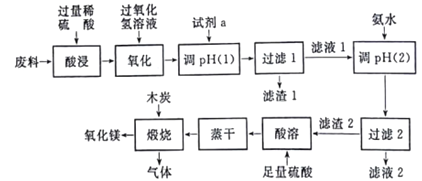
(1)��������в��÷���ԭ�ϡ����ȡ����衢�ʵ����������Ũ�ȵȴ�ʩ��Ŀ����______���ù���������Һ����ʱ�������ķ�Ӧ���ӷ���ʽΪ_________��
(2)Ϊ�˲�Ӱ���Ʒ�Ĵ��ȣ��Լ�aӦѡ��______(����)��
A.CuO B.Ca(OH)2 C.MgCO3 D.��ˮ
�����Լ�a����pH�����У������ɵij�����______����pH=5ʱ����Һ1��Al3+��Fe3+�����ʵ���Ũ��֮��Ϊ________(��֪:298Kʱ��Ksp[Al(OH)3]=3.0��10-34��Ksp[Fe(OH)3]=4.0��10-38)��
(3)д����������2�����ӷ���ʽ____________��
(4)���չ��̴������·�Ӧ:
2MgSO4+C=2MgO+2SO2��+CO2�� MgSO4+C=MgO+SO2��+CO�� MgSO4+3C=MgO+SO2��+3CO��
Ϊ�ⶨ���պ�����������и���ֺ�������������ʵ��:��������ȴ����״����ȡ22.4mL���壬��Ba(OH)2��Һ������գ�ʣ��7mL����(��״��)�����ó��������������ܽ⣬�پ����ˡ�ϴ�ӡ���������ó���0.1165g������������SO2��CO2��CO�����Ϊ_____(�����������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ũ�����ϡ����ķ����мȼ��ֿɿ����ǣ� ��
A.��ʯ����Һ��ӦB.��ͭƬ��Ӧ
C.����пƬ���Ƿ����������D.�ò�������պ����Ϳ��ֽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�� ��25��ʱ������ʵ���ƽ������Ka��CH3COOH���T1.8��10��5 �� Ka��HSCN���T0.13��
���ܵ���ʵ��ܶȻ�������KSD��CaF2���T1.5��10��10
��25��ʱ��2��l0��3molL��1�����ˮ��Һ�У�������ҺpH����������仯�����õ�c ��HF����C��F��������ҺpH�ı仯��ϵ����ͼ1��ʾ��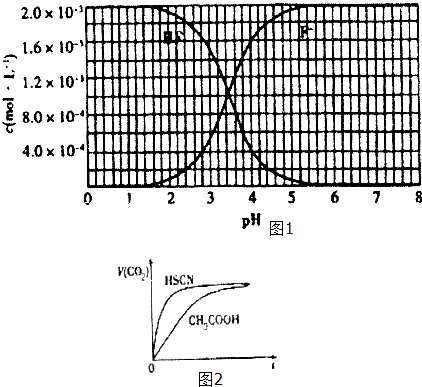
�����������Ϣ�ش��������⣺
��1��25��ʱ����20mL 0.10molL��1CH3COOH��Һ��20mL 0��l molL��1 HSCN��Һ�ֱ� ��20mL 0.10molL��1NaHCO3 ��Һ��ϣ�ʵ���ò��������������V����ʱ�䣨t���仯��ʾ��ͼΪͼ2��ʾ�� ��Ӧ��ʼ�Σ�������Һ����CO2��������ʴ������Բ����ԭ���� ��
��Ӧ��������������Һ�У�C��CH3COO����c��SCN���������������������=����
��2��25��ʱ��HF����ƽ�ⳣ������ֵKa�� ��
��3��4��10��3molL��1HF��Һ��4��10��4molL��1CaCl2��Һ�������ϣ����ڻ��ҺpHΪ4.0�����Ե��ڻ��Һ����ı仯����ͨ����ʽ����˵���Ƿ��г���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�����ڱ��ж����ڵ�һ���֣�A��B��C����Ԫ��ԭ�Ӻ���ĵ�����֮�͵���Bԭ�ӵ���������Bԭ�Ӻ��ڵ�����������������ȡ�������������ȷ���ǣ� ��
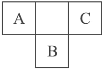
A. ����Ԫ�ص�ԭ�Ӱ뾶�Ĵ�С˳����B��C��A
B. AԪ������������Ӧ��ˮ�������ǿ������
C. BԪ�ص�������⻯���ˮ��Һ��������
D. CԪ���Ƿǽ�������ǿ��Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ԫ�أ�����B��C��D��EΪ����������Ԫ�أ�F��GΪ��������Ԫ�أ����ǵ�ԭ����������������������������Ϣ���ش�����
BԪ��ԭ�ӵĺ���p��������s��������1 |
Cԭ�ӵĵ�һ�����ĵ����ֱܷ��ǣ�I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
Dԭ�Ӻ�������p���ȫ������� |
EԪ�ص����������������������4 |
F ��ǰ������ԭ�ӵ����Ų�ͼ�е�����������Ԫ�� |
G�����ڱ��ĵ�ʮһ�� |
��1��B��̬ԭ�ӵĵ����Ų�ʽΪ��F��̬ԭ�ӵļ۵����Ų�ʽΪ��G��̬ԭ�ӵ����������Ų�ͼΪ ��
��2��C��������������Ԫ��ԭ�ӵĵ�һ�������ɴ�С��˳��������Ԫ�ط�����գ���
��3��B��D�ĵ縺����Դ�С��BD���á����ڡ�����С�ڡ����ڡ���գ���
��4����������Ԫ���У�λ��s�������֣�λ��p�������֣�
��5��DE3�ĵ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ϼ�G�����������кܶ���;,��ϳ�·������:

��֪:��R1��CHO+R2��CH2��CHO![]()
![]() (R1��R2������������ԭ��)
(R1��R2������������ԭ��)
��D��A��Ϊͬϵ��;����ͬ������,D����������������ܶ�Ϊ39��
(1)A��������____,G�к��������ŵ�������____��
(2)�ڵķ�Ӧ������____,B��F�Ľṹ��ʽ�ֱ�Ϊ______��______��
(3)д��һ���ܼ���A��D���Լ�:______;C�ж���ͬ���칹��,�������ڷ����廯�������____�֡�
(4)д����Ӧ�ٵĻ�ѧ����ʽ:_____________��
(5)G��ͬ���칹�� ��һ����Ҫ��ҩ���м���,��ϳ�·����G����,����
��һ����Ҫ��ҩ���м���,��ϳ�·����G����,����![]() Ϊԭ��������ĺϳ�·��(��������ԭ����ѡ)_________��
Ϊԭ��������ĺϳ�·��(��������ԭ����ѡ)_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ָ����(C5H8)nͨʽ�������Լ��䲻ͬ���ͳ̶Ⱥͺ�����������,�㷺�����ڶ�ֲ�����ڡ��������л���a��b�����������,�й����ǵ�˵������ȷ����
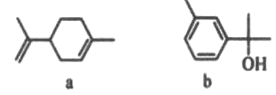
A. b�ķ���ʽΪC10H14O
B. a����Ԫ���ϵ�һ�ȴ��ﹲ��5��(�����������칹)
C. a��b����������̼ԭ�Ӿ�����ͬһƽ����
D. ��������ˮ������a��b
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com