
����Ŀ����������Ԫ�أ�����B��C��D��EΪ����������Ԫ�أ�F��GΪ��������Ԫ�أ����ǵ�ԭ����������������������������Ϣ���ش�����
BԪ��ԭ�ӵĺ���p��������s��������1 |
Cԭ�ӵĵ�һ�����ĵ����ֱܷ��ǣ�I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
Dԭ�Ӻ�������p���ȫ������� |
EԪ�ص����������������������4 |
F ��ǰ������ԭ�ӵ����Ų�ͼ�е�����������Ԫ�� |
G�����ڱ��ĵ�ʮһ�� |
��1��B��̬ԭ�ӵĵ����Ų�ʽΪ��F��̬ԭ�ӵļ۵����Ų�ʽΪ��G��̬ԭ�ӵ����������Ų�ͼΪ ��
��2��C��������������Ԫ��ԭ�ӵĵ�һ�������ɴ�С��˳��������Ԫ�ط�����գ���
��3��B��D�ĵ縺����Դ�С��BD���á����ڡ�����С�ڡ����ڡ���գ���
��4����������Ԫ���У�λ��s�������֣�λ��p�������֣�
��5��DE3�ĵ���ʽΪ ��
���𰸡�
��1��1s22s22p3��3d54s1�� ![]()
��2��Mg��Al��Na
��3������
��4��1��4
��5��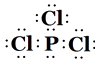
���������⣺��1��BΪNԪ�أ�ԭ�Ӻ�������Ų�Ϊ1s22s22p3��FΪCr����̬ԭ�ӵļ۵����Ų�ʽΪ3d54s1��GΪGa���������3�����ӣ���̬ԭ�ӵ����������Ų�ͼΪ ![]() �����Դ��ǣ�1s22s22p3��3d54s1��
�����Դ��ǣ�1s22s22p3��3d54s1�� ![]() ����2��CΪMgԪ�أ������Ϊȫ��������Ϊ�ȶ�����һ�����ܴ�С˳��ΪMg��Al��Na�����Դ��ǣ�Mg��Al��Na����3��ͬ����Ԫ�ش��ϵ��µ縺����С����N����P�����Դ��ǣ����ڣ���4����������Ԫ���У�Mgλ��s����N��P��Cl��Gaλ��p������4�֣����Դ��ǣ�1�� 4����5��PCl3Ϊ���ۻ��������ʽΪ
����2��CΪMgԪ�أ������Ϊȫ��������Ϊ�ȶ�����һ�����ܴ�С˳��ΪMg��Al��Na�����Դ��ǣ�Mg��Al��Na����3��ͬ����Ԫ�ش��ϵ��µ縺����С����N����P�����Դ��ǣ����ڣ���4����������Ԫ���У�Mgλ��s����N��P��Cl��Gaλ��p������4�֣����Դ��ǣ�1�� 4����5��PCl3Ϊ���ۻ��������ʽΪ 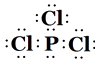 �����Դ��ǣ�
�����Դ��ǣ� 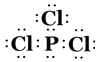 ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ֺ�����ﮡ��ܵ����͵��Ӳ��ϣ������в����ķ��������ɹۣ������е����Խ�����������ʽ���ڣ�����Co2O3��CoO����ʽ���ڣ������������ĵ����˫�棺﮻��������С�(��֪Co2O3��������>Cl2��������)�ӷ����л���������(CoO)�Ĺ����������£�
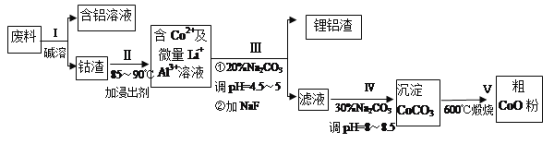
��֪����CoCO3���ܶȻ�Ϊ��Ksp=1.0��10-13��
����Һ������Ũ��С��1.0��10-5mol/Lʱ��Ϊ�����ӳ�����ȫ��
(1)�����ܡ�ǰͨ�������Ϸ��飬��Ŀ����____________��
(2)����I�в���NaOH��Һ�ܳ������е�A1����Ӧ�����ӷ���ʽΪ_________________��
(3)���̢��м���ϡH2SO4�ữ���ټ���Na2S2O3��Һ�����ܡ�������������ʵķ�Ӧ��ѧ����ʽΪ (������ֻ��һ�����) _______________________________________����ʵ����ģ�ҵ����ʱ��Ҳ������������ܣ���ʵ�ʹ�ҵ�����в������ᣬ�����������������ܵ���Ҫԭ��______________________________________��
(4)����III�õ����������Ҫ�ɷ���LiF��AI(OH)3��̼������Һ�ڲ��� Al(OH)3ʱ����Ҫ���ã���д���÷�Ӧ�����ӷ���ʽ__________________________________��
(5)��2.0��10-4 mol/LCoSO4��2.2��10-4mol/L��Na2CO3�������ϣ���ʱ��Һ�е�Co2+��Ũ��Ϊ__________��Co2+�Ƿ������ȫ? __________(��ǡ���)��
(6)CoO��������ɵ÷ۺ�ɫ��CoCl2��Һ��CoCl2���ᾧˮ��Ŀ��ͬ�����ֲ�ͬ��ɫ��������ɫ����ˮCoCl2��ˮ��ɫ��һ���ʿ��Ƴɱ�ɫˮ�������īˮ����ͼ�Ƿۺ�ɫ��CoCl2��6H2O�������ȷֽ�ʱ��ʣ������������¶ȱ仯�����ߣ�����B�Ļ�ѧʽ��____________________��

���𰸡� �� �� �� �� �� �� �� ��
��������(1). �����ܡ�ǰͨ�������Ϸ��飬����������巴Ӧ��ĽӴ�������ӿ췴Ӧ���ʣ��ʴ�Ϊ������Ӧ��Ӵ�������ӿ췴Ӧ���ʣ�
(2). NaOH��Һ��Al��Ӧ����ƫ�����ƺ����������ӷ���ʽΪ��2A1+2OH��+2H2O=2A1O2��+3H2�����ʴ�Ϊ��2A1+2OH��+2H2O=2A1O2��+3H2����
(3). ����������Co2O3��CoO����ʽ���ڣ��ܵĻ��ϼ�Ϊ+2�ۺ�+3�ۣ�������ͼ��֪������Na2S2O3��Һ����ȫ����Ϊ+2�ۣ�˵��Co3+����S2O32������ԭ����ΪCo2+���ɲ�����ֻ��һ��������ӿ�֪��������ΪSO42�������ݵ�ʧ�����غ��ԭ���غ㣬�����������ʵķ�Ӧ��ѧ����ʽΪ��4Co2O3��CoO+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O����������Ϣ��֪��Co2O3��������>Cl2�������ԣ���Co2O3��CoO�������������Cl2����Ⱦ����������ʵ�ʹ�ҵ�����в�����������������ʣ��ʴ�Ϊ��4Co2O3��CoO+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O��Co2O3��CoO�������������Cl2����Ⱦ������
(4). �ڹ���III�м���̼������Һ��̼������Ӻ������ӷ���˫ˮ�ⷴӦ���������������������ӷ���ʽΪ��2A13++3CO32��+3H2O=2A1(OH)3��+3CO2�����ʴ�Ϊ��2A13++3CO32��+3H2O=2A1(OH)3��+3CO2����
(5). ��2.0��10-4mol/LCoSO4��2.2��10-4mol/L��Na2CO3�������ϣ�Co2����CO32����Ӧ����CoCO3�����ӷ���ʽΪ��Co2��+ CO32��= CoCO3�������ӷ���ʽ��֪����Ӧ�����Һ��c(CO32��)=( 2.2��10-4��2.0��10-4)mol/L��2=1��10��5mol/L����Ӧ�����Һ��c(Co2��)=![]() =1.0��10-8mol/L��c(Co2��)��1.0��10-5mol/L������Co2��������ȫ���ʴ�Ϊ��1.0��10-8mol/L���ǣ�
=1.0��10-8mol/L��c(Co2��)��1.0��10-5mol/L������Co2��������ȫ���ʴ�Ϊ��1.0��10-8mol/L���ǣ�
(6). ��ͼ��֪��n(CoCl2)=65��10-3g��130g/mol=5��10-4mol��B�к���ˮ�����ʵ���Ϊn(H2O)=(74��65)��10-3g��18g/mol=5��10-4mol����n(CoCl2): n(H2O)=1:1��������BΪCoCl2��H2O���ʴ�Ϊ��CoCl2��H2O��
���͡�������
��������
10
����Ŀ����Ԫ�ع㷺��������Ȼ�磬�����仯���ﱻ������ũҩ�����ݼ���ɱ����ȡ�
(1)��ij�����������As2O3��As2O5������As2O5���ȶ��Բ����ͼ1д��As2O3ת��ΪAs2O5���Ȼ�ѧ����ʽ__________________________________��
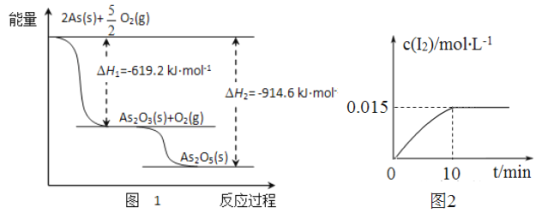
(2)�����ƾ��������ԣ�298Kʱ����100mL�ձ��м���10mL0.1 mol/L Na3AsO4��Һ��20mL0.1 mol/L KI��Һ��20mL0.05mol/L������Һ���������з�Ӧ��AsO43-(��ɫ)+12(dz��ɫ)+H2O ��H�������Һ��c(I2)��ʱ��(t)�Ĺ�ϵ��ͼ2��ʾ(��Һ����仯���Բ���)��
�������¶ȣ���Һ��AsO43-��ƽ��ת���ʼ�С����÷�Ӧ�ġ�H________0(����ڡ���С�ڡ����ڡ�)��
��0~10min�ڣ�I�ķ�Ӧ����v(I��)= ____________��
��������������������淴Ӧ�ﵽƽ��״̬����_______(����ĸ����)��
a.c(AsO33-)+c(AsO42-)���ٱ仯 b.��Һ��ɫ���ֲ��ٱ仯
C.c(AsO33-)��c(AsO42-)�ı�ֵ���ֲ��ٱ仯 d.I���������ʵ���I2����������
���ڸ������£�������Ӧƽ�ⳣ���ı���ʽK=______________��
(3)����(2)�з�Ӧ�ɲⶨ��As2O3��As2O5�������еĸ���ֺ���(�������ʶԲⶨ��Ӱ��)���������£�
�ٽ�����02000g����NaOH��Һ���õ���AO33-��AsO43-�Ļ����Һ��
���������Һ��0.02500 mol��L-1��I2��Һ�ζ����õ�����Һ��ָʾ������________________����ζ��ﵽ�յ㡣�ظ��ζ�3�Σ�ƽ������I2��Һ40.00mL����������As2O5������������_________(������λ��Ч����)�����ζ��յ�ʱ�����Ӷ�������������_________ (�ƫ�͡�����ƫ�ߡ�������Ӱ�족)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ի�����Ϊԭ���Ʊ��������������ķ������������÷������Լ��ٻ�����Ⱦ�����Ϊ������ҵ�ϣ������÷���(��Fe2+��Fe3+�������μ����� CaO��MgO)�Ʊ��ߵ���������(Fe2O3) �ͻ���(NH4)2SO4�����������������¡�
��֪:炙������Ļ�ѧʽΪ(NH4)2Fe6(SO4)4(OH)12��
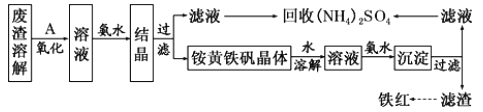
��1���ڷ����ܽ����ʱ��Ӧѡ��________�ܽ�(����ĸ)��
A����ˮ B������������Һ C������ D������
��2��Ϊ����߷����ܽ�ʱ�Ľ�ȡЧ�ʣ��ɲ��õĴ�ʩ����Щ��___________________��д��һ�㼴�ɣ���
��3������A ��һ������������ҵ��һ��ѡ�ÿ�������������___________�����������з�����Ӧ�����ӷ���ʽΪ_________________��
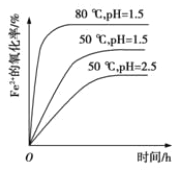
��4��������ͼ�й����ݣ�����Ϊ��ҵ����������ʱӦ���Ƶ�����¶Ⱥ�pH�ǣ�______��
��5�� 炙������� ���ܻ��е� ������ Fe(OH)3��____________�� 炙������백ˮ��Ӧ�����ӷ���ʽΪ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��H2SO3�������ε���Һ�У�H2SO3��HSO3-��SO32-�����ʵ�������(��)����ҺpH�仯��ϵ����ͼ��ʾ����������������ǣ� ��
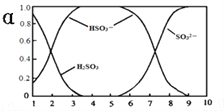
A. ��Һ��pH=5ʱ����Ԫ�ص���Ҫ������ʽΪHSO3-
B. ����Һǡ�ó�����ʱ��c(Na+)>c(SO32-)+c(HSO3-)
C. ��pH=8��������Һ�еμ���������ʯ��ˮ��![]() ��ֵ����
��ֵ����
D. ��pH=3��������Һ�еμ�����ϡ����,��(HSO3-)��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijҩ���к���As��Cu��H��O��Cl��Fe��Ԫ�ء�
(1)Cu�����ڲ�ͬ�����¿��γɾ���ͷǾ���,��ͨ��______���־���ͷǾ���;��̬Cuԭ�ӵļ۵����Ų�ʽΪ____,��̬Cuԭ�ӵĺ�������Ų�����___������״̬�෴�ĵ��ӡ�
(2)CH4������Cԭ�ӵ��ӻ���ʽΪ____,NH3�е��CH4�ߵ�ԭ����________��
(3)����:H3AsO4___________H3AsO3,ԭ��______________��
(4)H3O+��H2O��Ƚ�,���ǽϴ����______,��ԭ����_____________��
(5)һ��Fe���徧����ͼ��ʾ,�����߳�Ϊa cm,��֪�þ�����ܶ�Ϊ�� g��cm-3,Fe�����ԭ������ΪM,NAΪ�����ӵ�������ֵ,NA=____(��ʽ��ʾ����)��
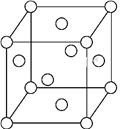
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʯī��;���Ǣ��и�������������缫����װ��Ʒ
A.�٢�B.�ڢ�C.�٢�D.�٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10.0mL 0.10molL��1��ˮ�е���0.10molL��1�����ᣬ��Һ��pH����������������ϵ��ͼ��ʾ�������������ݳ����������й�������ȷ���ǣ������� 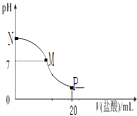
A.M��N��һ������c��Cl������c��NH4+����c��OH������c��H+��
B.M���Ӧ���������Ϊ10.0mL
C.pH=7��Һ����c��NH4+��=c��Cl����=c��H+��=c��OH����
D.P�㴦����Һ�д��ڣ�2c��NH4+��+2c��NH3H2O��=c��Cl����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��298 Kʱ������Ӧ��ƽ�ⳣ�����£�
��N2(g)��O2(g)![]() 2NO(g)��K��1��10��30��
2NO(g)��K��1��10��30��
��2H2(g)��O2(g)![]() 2H2O(g)��K��2��1081��
2H2O(g)��K��2��1081��
��2CO2(g)![]() 2CO(g)��O2(g)��K��4��10��92
2CO(g)��O2(g)��K��4��10��92
�����£�NO��H2O��CO2������������ֽ����������������( )
A���� B���� C���� D�����ж�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ϸ��������ɵ���������ȷ����
A. �������ϸ������ԭ�ӵ���Ŀ���
B. ֬��ϸ���������Ļ�������֬��
C. ÿ��ϸ���������л������Ķ��ǵ�����
D. ��ɵ����ʵ�Ԫ��һ����C��H��O��N
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com