
【题目】某药物中含有As、Cu、H、O、Cl、Fe等元素。
(1)Cu单质在不同条件下可形成晶体和非晶体,可通过______区分晶体和非晶体;基态Cu原子的价电子排布式为____,基态Cu原子的核外电子排布中有___对自旋状态相反的电子。
(2)CH4分子中C原子的杂化方式为____,NH3沸点比CH4高的原因是________。
(3)酸性:H3AsO4___________H3AsO3,原因______________。
(4)H3O+、H2O相比较,键角较大的是______,其原因是_____________。
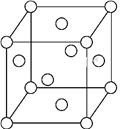
(5)一种Fe晶体晶胞如图所示,晶胞边长为a cm,已知该晶体的密度为ρ g·cm-3,Fe的相对原子质量为M,NA为阿伏加德罗常数的值,NA=____(列式表示即可)。
【答案】 X射线衍射实验 3d104s1 14 sp3杂化 氨分子之间可以形成氢键,而甲烷分子之间只存在范德华力 > H3AsO4中的非羟基氧原子比H3AsO3中多,H3AsO4中As对电子的吸引力更强,使O—H键更易断裂,电离出H+ H3O+ H3O+、H2O中O原子都是sp3杂化,H2O中O原子有2对孤电子对,H3O+中O原子有1对孤电子对,孤电子对越多,对成键电子对的排斥力越大,键角越小 ![]()
【解析】(1)区分晶体和非晶体,可通过X射线衍射实验区分,铜是29号元素,基态Cu原子的价电子排布式为3d104s1,29个电子占据15个轨道,其中14个轨道中的电子自旋状态相反,故答案为:X射线衍射实验;3d104s1;14;
(2)CH4分子中C原子的价层电子对数=4,采用sp3杂化,氨分子之间可以形成氢键,而甲烷分子之间只存在范德华力,使得NH3沸点比CH4高,故答案为:sp3杂化;氨分子之间可以形成氢键,而甲烷分子之间只存在范德华力;
(3) H3AsO4中的非羟基氧原子数目大于H3AsO3,酸性:H3AsO4>H3AsO3,故答案为:>;H3AsO4中的非羟基氧原子比H3AsO3中多,H3AsO4中As对电子的吸引力更强,使O—H键更易断裂,电离出H+;
(4) H3O+、H2O中O原子都是sp3杂化,H2O中O原子有2对孤电子对,H3O+中O原子有1对孤电子对,孤电子对越多,对成键电子对的排斥力越大,键角越小,因此H3O+、H2O相比较,键角较大的是H3O+,故答案为:H3O+;H3O+、H2O中O原子都是sp3杂化,H2O中O原子有2对孤电子对,H3O+中O原子有1对孤电子对,孤电子对越多,对成键电子对的排斥力越大,键角越小;
(5)根据晶胞结构图,1个晶胞中含有的铁原子数=8×![]() +6×
+6×![]() =4,因此晶体的密度为ρ g·cm-3=
=4,因此晶体的密度为ρ g·cm-3=![]() ,解得NA=
,解得NA=![]() ,故答案为:
,故答案为: ![]() 。
。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】设 NA为阿伏加德罗常数的数值.下列说法正确的是
A. 标准状况下, 78g 苯中含有碳碳双键的数目是 3 NA
B. 18g D2O 含有 10NA个质子
C. 28 g 聚乙烯中含有的原子数目为 6NA
D. 56g 铁片投入足量浓 H2SO4中生成 NA个 SO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于SO2的叙述正确的是( )
A.SO2是无色无味有毒的气体B.SO2有毒,不能做食品添加剂
C.SO2不溶于水D.SO2与NaOH反应能生成Na2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: ①25℃时弱电解质电离平衡数;Ka(CH3COOH)═1.8×10﹣5 , Ka(HSCN)═0.13;
难溶电解质的溶度积常数:KSD(CaF2)═1.5×10﹣10
②25℃时,2×l0﹣3molL﹣1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c (HF)、C(F﹣)与溶液pH的变化关系,如图1所示: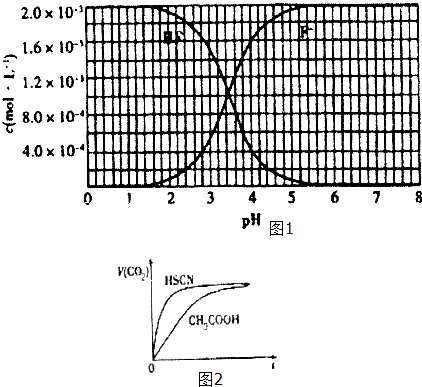
请根据以下信息回答下列问题:
(1)25℃时,将20mL 0.10molL﹣1CH3COOH溶液和20mL 0.l molL﹣1 HSCN溶液分别 与20mL 0.10molL﹣1NaHCO3 溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示: 反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ,
反应结束后所得两溶液中,C(CH3COO﹣)c(SCN﹣)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka≈ .
(3)4×10﹣3molL﹣1HF溶液与4×10﹣4molL﹣1CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
B元素原子的核外p电子数比s电子数少1 |
C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
D原子核外所有p轨道全满或半满 |
E元素的主族序数与周期数的相差4 |
F 是前四周期原子电子排布图中单电子数最多的元素 |
G在周期表的第十一列 |
(1)B基态原子的电子排布式为;F基态原子的价电子排布式为;G基态原子的最外层电子排布图为 .
(2)C和与其左右相邻元素原子的第一电离能由大到小的顺序是(用元素符号填空).
(3)B、D的电负性相对大小:BD(用“大于”、“小于”或“等于”填空).
(4)以上六种元素中,位于s区的有种,位于p区的有种.
(5)DE3的电子式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种性能优异的新型材料,在许多领域有广泛应用,前景广阔。某化学小组模拟工业制氮化铝原理,欲在实验室制备氮化铝并检验其纯度。
查阅资料:①实验室用饱和NaNO2与NH4Cl溶液共热制N2:NaNO2+NH4Cl![]() NaCl+N2↑+2H2O。
NaCl+N2↑+2H2O。
②工业制氮化铝:Al2O3+3C+N2![]() 2AlN+3CO,氮化铝在高温下能水解。
2AlN+3CO,氮化铝在高温下能水解。
③AlN与NaOH饱和溶液反应:AlN+NaOH+H2O![]() NaAlO2+NH3↑。
NaAlO2+NH3↑。
Ⅰ.氮化铝的制备
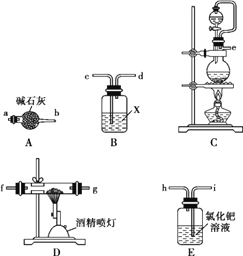
(1)实验中使用的装置如上图所示,请按照氮气气流方向将各仪器接口连接:e→c→d→____________(根据实验需要,上述装置可使用多次)。
(2)B装置内的X液体可能是____;E装置内氯化钯溶液的作用可能是_______。
Ⅱ.氮化铝纯度的测定
【方案ⅰ】甲同学用下图装置测定AlN的纯度(部分夹持装置已略去)。
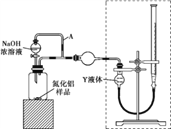
(3)为准确测定生成气体的体积,量气装置(虚线框内)中的Y液体可以是____。
a.CCl4 b.H2O c.NH4Cl饱和溶液 d.植物油
(4)若装置中分液漏斗与导气管之间没有导管A连通,对所测AlN纯度的影响是____ (填“偏大”“偏小”或“不变”)。
【方案ⅱ】乙同学按以下步骤测定样品中AlN的纯度。
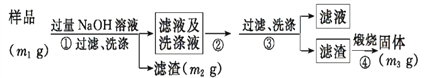
(5)步骤②的操作是_________。
(6)实验室里煅烧滤渣使其分解,除了必要的热源和三脚架以外,还需要的仪器有______等。
(7) 样品中AlN的纯度是__________(用m1、m2、m3表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机化合物的说法正确的是
A. 全降解塑料![]() 可由单体环氧丙烷
可由单体环氧丙烷![]() 和CO2缩聚制得
和CO2缩聚制得
B. C4H8O2 的同分异构体中属于酯类的有 5 种
C. 苯乙烯分子中所有原子不可能在同一个平面上
D. 有机物![]() 可发生加成、取代、氧化、酯化、水解反应
可发生加成、取代、氧化、酯化、水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20m1某稀Ba(OH)2溶液中滴入浓度为0.1mol/L的醋酸。溶液中由水电离出的氢氧根离子浓度随滴入醋酸的体积变化如图,下列分析正确的是

A. 稀Ba(OH)2溶液的浓度为0.1molL-1
B. C点溶液的PH=a
C. D点溶液中C(OH-)<C(H+)+C(CH2COOH)
D. E点溶液中存在C(CH2COO-)>C(Ba2+)>C(OH-)>C(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com