
【题目】下列关于SO2的叙述正确的是( )
A.SO2是无色无味有毒的气体B.SO2有毒,不能做食品添加剂
C.SO2不溶于水D.SO2与NaOH反应能生成Na2SO3
科目:高中化学 来源: 题型:
【题目】如图所示的钢铁腐蚀中下列说法正确的是( ) 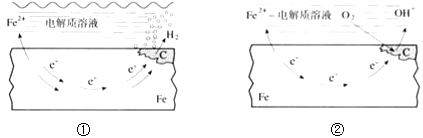
A.碳表面发生氧化反应
B.钢铁被腐蚀的最终产物为FeO
C.生活中钢铁制品的腐蚀以图①所示为主
D.图②中,正极反应式为O2+4e﹣+2H2O═4OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 W、X、Y、Z 的原子序数依次递增,a、b、c、d、e、f 是由这些元素组成的化合物,d为淡黄色的离子化合物,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法正确的是
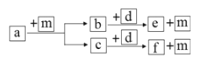
A. 原子半径: W<X<Y<Z
B. 阴离子的还原性: Y>W
C. 图中物质的转化过程均为氧化还原反应
D. a 一定由 W、X 两种元素组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A 是石油裂解气的主要产物之一,其产量常用于衡量一个国家石油化工发展水平的标志。下列是有机物 A~G 之间的转化关系:
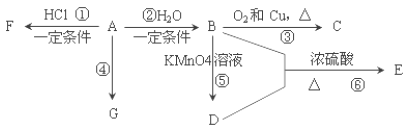
请回答下列问题:
(1)A 的官能团的名称是___________; C 的结构简式是________;
(2)E 是一种具有香味的液体, 由 B+D→E 的反应方程式为___________, 该反应类型是______________;
(3)G 是一种高分子化合物,其结构简式是______________;
(4)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射物质 F(沸点 12.27°C)进行应急处理.写出由A 制 F 的化学反应方程式______________。
(5)E 的同分异构体能与 NaHCO3溶液反应,写出该同分异构体的结构简式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:

①下列说法正确的是__________。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的 pH 均增大
②在相同时间内, 两烧杯中产生气泡的速度: 甲__________乙(填“>”、 “<”或“=”)。
③请写出图中构成原电池的负极电极反应式: ____________。
④当甲中溶液质量增重 31.5 克时,电极上转移电子数目为______。
(2)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是 KOH。通甲烷一极的电极反应方程式为 ______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铁矿为原料制备硫酸会产生大量的废渣,合理利用废渣可以减少环境污染,变废为宝。工业上,可利用废渣(含Fe2+、Fe3+的硫酸盐及少量 CaO和MgO)制备高档颜料铁红(Fe2O3) 和回收(NH4)2SO4,具体生产流程如下。
已知:铵黄铁矾的化学式为(NH4)2Fe6(SO4)4(OH)12。
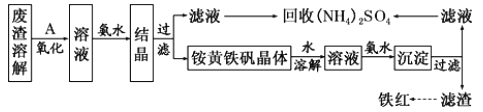
(1)在废渣溶解操作时,应选用________溶解(填字母)。
A.氨水 B.氢氧化钠溶液 C.盐酸 D.硫酸
(2)为了提高废渣溶解时的浸取效率,可采用的措施有哪些?___________________(写出一点即可)。
(3)物质A 是一种氧化剂,工业上一般选用空气,其理由是___________。氧化过程中发生反应的离子方程式为_________________。
(4)根据下图有关数据,你认为工业上氧化操作时应控制的最佳温度和pH是:______。
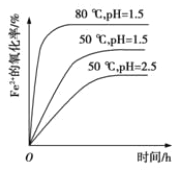
(5) 铵黄铁矾中 可能混有的 杂质有 Fe(OH)3、____________。 铵黄铁矾与氨水反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度相同,浓度均为0.2 mol·L-1的①(NH4)2SO4,②NaNO3,③NH4HSO4,④NH4NO3,⑤CH3COONa溶液,它们的pH由小到大的排列顺序是( )
A. ③①④②⑤
B. ①③⑤④②
C. ③②①⑤④
D. ⑤②④①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某药物中含有As、Cu、H、O、Cl、Fe等元素。
(1)Cu单质在不同条件下可形成晶体和非晶体,可通过______区分晶体和非晶体;基态Cu原子的价电子排布式为____,基态Cu原子的核外电子排布中有___对自旋状态相反的电子。
(2)CH4分子中C原子的杂化方式为____,NH3沸点比CH4高的原因是________。
(3)酸性:H3AsO4___________H3AsO3,原因______________。
(4)H3O+、H2O相比较,键角较大的是______,其原因是_____________。
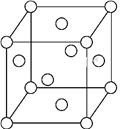
(5)一种Fe晶体晶胞如图所示,晶胞边长为a cm,已知该晶体的密度为ρ g·cm-3,Fe的相对原子质量为M,NA为阿伏加德罗常数的值,NA=____(列式表示即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体的一种免疫球蛋白由764个氨基酸、4条肽链构成,则该蛋白质分子中含有的肽键数和形成蛋白质过程中脱去的水分子数分别为
A. 760,760 B. 760,763 C. 763,763 D. 763,760
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com