
����Ŀ��ԭ���ԭ���ķ����Ǵ��ܺ��ܼ����ľ�������ǻ�ѧ�������һ���ش��ס�
��1������пƬ�ʹ�ͭƬ��ͼ��ʽ����100 mL��ͬŨ�ȵ�ϡ������һ��ʱ�䣬�ش��������⣺

������˵����ȷ����__________��
A���ס��Ҿ�Ϊ��ѧ��ת��Ϊ���ܵ�װ�� B������ͭƬ��û�����Ա仯
C������ͭƬ�������١�����пƬ�������� D�����ձ�����Һ�� pH ������
������ͬʱ���ڣ� ���ձ��в������ݵ��ٶȣ� ��__________��(�>���� ��<������)��
����д��ͼ�й���ԭ��صĸ����缫��Ӧʽ�� ____________��
�ܵ�������Һ�������� 31.5 ��ʱ���缫��ת�Ƶ�����ĿΪ______��
��2��ͼ��Ϊ��������ȼ�ϵ�صĹ���ʾ��ͼ���������Һ�������� KOH��ͨ����һ���ĵ缫��Ӧ����ʽΪ ______________________________________________��
���𰸡� BD > Zn��2e��===Zn2�� NA CH4+10OH��-8e-=CO32-+7H2O
����������1����A������ԭ��ع�����������������ԭ��أ��Ҳ��ܹ��ɱպϻ�·�����Բ��ܹ���ԭ��أ�ѡ��A����B���Ҳ��ܹ���ԭ��أ���������пƬ�ϵõ��ӷ�����ԭ��Ӧ����������ͭƬ��û�����Ա仯��ѡ��B��ȷ��C������ͭƬ�������������������ӵõ�����������������ͭƬ�������䣬����пƬ�������ӷ����û���Ӧ�������������٣�ѡ��C����D�����ձ���п�������ӷ����û���Ӧ������Һ��������Ũ�ȼ�С�������ձ�����Һ��c��H+������С��ѡ��D��ȷ����ѡBD���ڼ��ܹ���ԭ��أ��Ҳ��ܹ���ԭ��أ���ԭ��ظ����Ľ������ٱ���ʴ����������ͬʱ���ڣ����ձ��в������ݵ��ٶȣ��ף��ң���п�Ľ�����ǿ��ͭ��п��Ϊ������ԭ��صĸ����缫��ӦʽΪZn��2e��=Zn2�����ܼ���������ӦΪ2H++2e��= H2������Һ�������� 31.5g��32.5g-1g��ʱ������0.5molZn���缫��ת�Ƶ�����ĿΪNA����2��ͼ��Ϊ��������ȼ�ϵ�صĹ���ʾ��ͼ���������Һ�������� KOH��ͨ����һ��Ϊ���������������¼���ʧ��������̼������ӣ��缫��Ӧ����ʽΪCH4+10OH��-8e-=CO32-+7H2O��


 ��Կ���Ծ�ϵ�д�
��Կ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڳ����л����˵������ȷ����
A. �Ҵ������ᶼ�������Ʒ�Ӧ
B. ��֬���ͺ�֬����ͳ�ƣ����Ǹ�֬����������γɵ���
C. 1mol�л��� һ���������ܺ�6molNaOH��Ӧ
һ���������ܺ�6molNaOH��Ӧ
D. ����ʽΪC4H7ClO2������NaHCO3��Һ��Ӧ����CO2���л�����ܽṹ��6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ-��������ȼ�ϵ�ؾ��б������ߡ���ȫ������ŵ㡣��ṹʾ��ͼ��ͼ��ʾ�����ڸõ�ص�������ȷ����
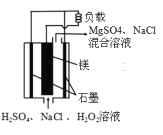
A. �õ�����ڸ�������������
B. ��������ʱ�� H+�� Mg �缫�ƶ�
C. ��ع���ʱ��������Χ��Һ��pH�����ϱ�С
D. �õ�ص��ܷ�ӦʽΪ: �õ�ص��ܷ�ӦʽΪMg��H2O2��H2SO4��MgSO4��2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.4mol CuSO4��0.4mol NaCl����ˮ�����1L��Һ���ö��Ե缫���е�⣬��һ���缫�õ�0.3mol Cuʱ����һ���缫�����ɵ������ڱ�״���µ�����ǣ�������
A.5.6L
B.6.72L
C.1.344L
D.11.2L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���в���ȷ���ǣ� ��
A.����һ�ֻ�ɫ��������ˮ�Ĺ���
B.������Ȼ���м��л���̬��������̬����
C.�������Ӧ����������
D.���ڿ����е�ȼ�ղ����Ƕ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���SO2��������ȷ���ǣ� ��
A.SO2����ɫ��ζ�ж�������B.SO2�ж���������ʳƷ���Ӽ�
C.SO2������ˮD.SO2��NaOH��Ӧ������Na2SO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ũ��������ʣ�����˵��������ǣ� ��
A.Ũ�������ˮ���ǻ�ѧ�仯B.Ũ���������Ժ�ǿ������
C.Ũ��������ˮ�Ժ���ˮ��D.Ũ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���ݻ����ܱ������н��з�Ӧ��N2(g)+3H2(g)![]() 2NH3(g)����֪��Ӧ������ijһʱ��N2��H2��NH3��Ũ�ȷֱ�Ϊ0.1mol/L��0.3mol/L��0.2mol/L������Ӧ�ﵽƽ��ʱ�����ܴ��ڵ�������
2NH3(g)����֪��Ӧ������ijһʱ��N2��H2��NH3��Ũ�ȷֱ�Ϊ0.1mol/L��0.3mol/L��0.2mol/L������Ӧ�ﵽƽ��ʱ�����ܴ��ڵ�������
A. N2Ϊ0.2mol/L��H2Ϊ0.6mol/L B. N2Ϊ0.15mol/L
C. N2��H2��Ϊ0.18 mol/L D. NH3Ϊ0.4mol/L
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com