
【题目】氮化铝(AlN)是一种性能优异的新型材料,在许多领域有广泛应用,前景广阔。某化学小组模拟工业制氮化铝原理,欲在实验室制备氮化铝并检验其纯度。
查阅资料:①实验室用饱和NaNO2与NH4Cl溶液共热制N2:NaNO2+NH4Cl![]() NaCl+N2↑+2H2O。
NaCl+N2↑+2H2O。
②工业制氮化铝:Al2O3+3C+N2![]() 2AlN+3CO,氮化铝在高温下能水解。
2AlN+3CO,氮化铝在高温下能水解。
③AlN与NaOH饱和溶液反应:AlN+NaOH+H2O![]() NaAlO2+NH3↑。
NaAlO2+NH3↑。
Ⅰ.氮化铝的制备
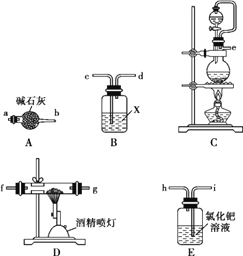
(1)实验中使用的装置如上图所示,请按照氮气气流方向将各仪器接口连接:e→c→d→____________(根据实验需要,上述装置可使用多次)。
(2)B装置内的X液体可能是____;E装置内氯化钯溶液的作用可能是_______。
Ⅱ.氮化铝纯度的测定
【方案ⅰ】甲同学用下图装置测定AlN的纯度(部分夹持装置已略去)。
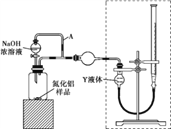
(3)为准确测定生成气体的体积,量气装置(虚线框内)中的Y液体可以是____。
a.CCl4 b.H2O c.NH4Cl饱和溶液 d.植物油
(4)若装置中分液漏斗与导气管之间没有导管A连通,对所测AlN纯度的影响是____ (填“偏大”“偏小”或“不变”)。
【方案ⅱ】乙同学按以下步骤测定样品中AlN的纯度。
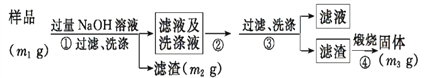
(5)步骤②的操作是_________。
(6)实验室里煅烧滤渣使其分解,除了必要的热源和三脚架以外,还需要的仪器有______等。
(7) 样品中AlN的纯度是__________(用m1、m2、m3表示)。
【答案】 a→b→f(g)→g(f)→a(c)→b(d)→I 浓硫酸 吸收CO,防止污染 ad 偏大 通入过量CO2气体 坩埚、泥三角、坩埚钳 ![]() ×100%
×100%
【解析】(1) 实验室用饱和NaNO2与NH4Cl溶液共热制N2:NaNO2+NH4Cl![]() NaCl+N2↑+2H2O,可以需要装置C制备氮气,生成的氮气中经过干燥后与Al2O3和C在装置D中反应生成AlN和CO,CO会污染空气,可以通过氯化钯溶液吸收,氮化铝在高温下能水解,需要防止外界水蒸气进入装置D,因此按照氮气气流方向,各仪器接口连接顺序为:e→c→d→a→b→f(g)→g(f)→a(c)→b(d)→I,故答案为:a→b→f(g)→g(f)→a(c)→b(d)→I;
NaCl+N2↑+2H2O,可以需要装置C制备氮气,生成的氮气中经过干燥后与Al2O3和C在装置D中反应生成AlN和CO,CO会污染空气,可以通过氯化钯溶液吸收,氮化铝在高温下能水解,需要防止外界水蒸气进入装置D,因此按照氮气气流方向,各仪器接口连接顺序为:e→c→d→a→b→f(g)→g(f)→a(c)→b(d)→I,故答案为:a→b→f(g)→g(f)→a(c)→b(d)→I;
(2)根据上述分析,B装置内的X液体可以是浓硫酸;E装置内氯化钯溶液是用来吸收CO,防止污染,故答案为:浓硫酸;吸收CO,防止污染;
(3) AlN+NaOH+H2O= NaAlO2+NH3↑,量气装置中收集的气体为氨气。a.氨气是极性分子,难溶于CCl4,可以选用;b.氨气极易溶于水,不能选用;c.氨气在NH4Cl饱和溶液中溶解度仍然很大,不能选用;d.氨气难溶于植物油,可以选用;故选ad;
(4)若装置中分液漏斗与导气管之间没有导管A连通,,应用氢氧化钠溶液体积的影响会使得测得的氨气的体积偏大,所测AlN纯度偏大,故答案为:偏大;
(5)根据流程图,滤液即洗涤液中含有NaAlO2,经过步骤②得到沉淀为氢氧化铝,因此步骤②是通入过量CO2气体,故答案为:通入过量CO2气体;
(6)实验室里煅烧滤渣氢氧化铝使其分解,除了必要的热源和三脚架以外,还需要的仪器有坩埚、泥三角、坩埚钳,故答案为:坩埚、泥三角、坩埚钳;
(7)根据Al2O3+3C+N2![]() 2AlN+3CO,AlN+NaOH+H2O= NaAlO2+NH3↑,样品的主要成分为Al2O3、C和 AlN,滤渣为C,最终的固体为Al2O3,因此由AlN反应得到的氧化铝的质量为m3-m1+m2,根据铝元素守恒,AlN的质量为
2AlN+3CO,AlN+NaOH+H2O= NaAlO2+NH3↑,样品的主要成分为Al2O3、C和 AlN,滤渣为C,最终的固体为Al2O3,因此由AlN反应得到的氧化铝的质量为m3-m1+m2,根据铝元素守恒,AlN的质量为![]() ×2×41g/mol=
×2×41g/mol=![]() g,样品中AlN的纯度为
g,样品中AlN的纯度为![]() ×100%,故答案为:
×100%,故答案为: ![]() ×100%。
×100%。


科目:高中化学 来源: 题型:
【题目】短周期元素 W、X、Y、Z 的原子序数依次递增,a、b、c、d、e、f 是由这些元素组成的化合物,d为淡黄色的离子化合物,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法正确的是
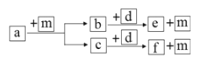
A. 原子半径: W<X<Y<Z
B. 阴离子的还原性: Y>W
C. 图中物质的转化过程均为氧化还原反应
D. a 一定由 W、X 两种元素组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度相同,浓度均为0.2 mol·L-1的①(NH4)2SO4,②NaNO3,③NH4HSO4,④NH4NO3,⑤CH3COONa溶液,它们的pH由小到大的排列顺序是( )
A. ③①④②⑤
B. ①③⑤④②
C. ③②①⑤④
D. ⑤②④①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某药物中含有As、Cu、H、O、Cl、Fe等元素。
(1)Cu单质在不同条件下可形成晶体和非晶体,可通过______区分晶体和非晶体;基态Cu原子的价电子排布式为____,基态Cu原子的核外电子排布中有___对自旋状态相反的电子。
(2)CH4分子中C原子的杂化方式为____,NH3沸点比CH4高的原因是________。
(3)酸性:H3AsO4___________H3AsO3,原因______________。
(4)H3O+、H2O相比较,键角较大的是______,其原因是_____________。
(5)一种Fe晶体晶胞如图所示,晶胞边长为a cm,已知该晶体的密度为ρ g·cm-3,Fe的相对原子质量为M,NA为阿伏加德罗常数的值,NA=____(列式表示即可)。
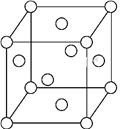
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1mL 0.1molL﹣1的H2SO4溶液加入纯水中制成200mL溶液,该溶液中由水自身电离产生的c(H+)最接近于( )
A.1×10﹣3 molL﹣1
B.1×10﹣13 molL﹣1
C.1×10﹣7 molL﹣1
D.1×10﹣11 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10.0mL 0.10molL﹣1氨水中滴入0.10molL﹣1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( ) 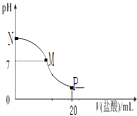
A.M﹣N间一定存在c(Cl﹣)>c(NH4+)>c(OH﹣)>c(H+)
B.M点对应的盐酸体积为10.0mL
C.pH=7溶液中有c(NH4+)=c(Cl﹣)=c(H+)=c(OH﹣)
D.P点处的溶液中存在:2c(NH4+)+2c(NH3H2O)=c(Cl﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体的一种免疫球蛋白由764个氨基酸、4条肽链构成,则该蛋白质分子中含有的肽键数和形成蛋白质过程中脱去的水分子数分别为
A. 760,760 B. 760,763 C. 763,763 D. 763,760
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应既属于氧化还原反应又属于吸热反应的是
A.铝片和稀盐酸反应B.氢氧化钡晶体和氯化铵反应
C.灼热的碳与CO2反应D.甲烷在氧气中燃烧。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com