
【题目】将1mL 0.1molL﹣1的H2SO4溶液加入纯水中制成200mL溶液,该溶液中由水自身电离产生的c(H+)最接近于( )
A.1×10﹣3 molL﹣1
B.1×10﹣13 molL﹣1
C.1×10﹣7 molL﹣1
D.1×10﹣11 molL﹣1
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】镁-过氧化氢燃料电池具有比能量高。安全方便等优点。其结构示意图如图所示、关于该电池的叙述正确的是
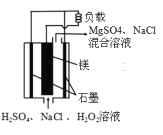
A. 该电池能在高温下正常工作
B. 电流工作时, H+向 Mg 电极移动
C. 电池工作时,正极周围溶液的pH将不断变小
D. 该电池的总反应式为: 该电池的总反应式为Mg+H2O2+H2SO4=MgSO4+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于浓硫酸的性质,下列说法错误的是( )
A.浓硫酸的吸水性是化学变化B.浓硫酸有酸性和强氧化性
C.浓硫酸有吸水性和脱水性D.浓硫酸能做干燥剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种性能优异的新型材料,在许多领域有广泛应用,前景广阔。某化学小组模拟工业制氮化铝原理,欲在实验室制备氮化铝并检验其纯度。
查阅资料:①实验室用饱和NaNO2与NH4Cl溶液共热制N2:NaNO2+NH4Cl![]() NaCl+N2↑+2H2O。
NaCl+N2↑+2H2O。
②工业制氮化铝:Al2O3+3C+N2![]() 2AlN+3CO,氮化铝在高温下能水解。
2AlN+3CO,氮化铝在高温下能水解。
③AlN与NaOH饱和溶液反应:AlN+NaOH+H2O![]() NaAlO2+NH3↑。
NaAlO2+NH3↑。
Ⅰ.氮化铝的制备
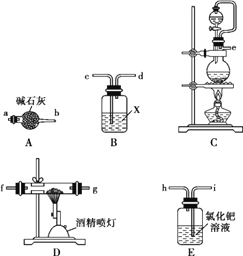
(1)实验中使用的装置如上图所示,请按照氮气气流方向将各仪器接口连接:e→c→d→____________(根据实验需要,上述装置可使用多次)。
(2)B装置内的X液体可能是____;E装置内氯化钯溶液的作用可能是_______。
Ⅱ.氮化铝纯度的测定
【方案ⅰ】甲同学用下图装置测定AlN的纯度(部分夹持装置已略去)。
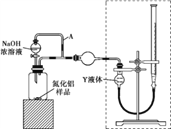
(3)为准确测定生成气体的体积,量气装置(虚线框内)中的Y液体可以是____。
a.CCl4 b.H2O c.NH4Cl饱和溶液 d.植物油
(4)若装置中分液漏斗与导气管之间没有导管A连通,对所测AlN纯度的影响是____ (填“偏大”“偏小”或“不变”)。
【方案ⅱ】乙同学按以下步骤测定样品中AlN的纯度。
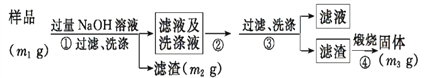
(5)步骤②的操作是_________。
(6)实验室里煅烧滤渣使其分解,除了必要的热源和三脚架以外,还需要的仪器有______等。
(7) 样品中AlN的纯度是__________(用m1、m2、m3表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定容积的密闭容器中进行反应;N2(g)+3H2(g)![]() 2NH3(g)。己知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.2mol/L。当反应达到平衡时,可能存在的数据是
2NH3(g)。己知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.2mol/L。当反应达到平衡时,可能存在的数据是
A. N2为0.2mol/L;H2为0.6mol/L B. N2为0.15mol/L
C. N2、H2均为0.18 mol/L D. NH3为0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学工业中Mn可用作氧化剂、助燃剂、活性电极材料、催化剂、油漆和油墨的干燥剂等,碳酸锰矿可作为制备MnO2原料
(1)已知25℃,101kPa时有如下的三个热化学方程式
①MnCO3(s) ![]() MnO(s)+CO2(g) △H1=+116 6kJ/mol
MnO(s)+CO2(g) △H1=+116 6kJ/mol
②2MnO(s)+O2(g) ![]() 2MnO2(s) △H2=-272.0kJ/mol
2MnO2(s) △H2=-272.0kJ/mol
③2MnCO3(s)+O2(g) ![]() 2Mn2(s)+2CO2(g) △H3
2Mn2(s)+2CO2(g) △H3
则△H3=_________;反应②在________条件下(填“高温”、“低温”或“任何温度”)能自发进行。
(2)在密闭容器中投入足量的 MnCO3,在一定条件下发生反应:MnCO3(s) ![]() Mno(s)+CO2(g) △H1=+116.6kJ/mol。一定温度下,达到平衡状态时p(CO2)=bMPa
Mno(s)+CO2(g) △H1=+116.6kJ/mol。一定温度下,达到平衡状态时p(CO2)=bMPa
①温度、压强对碳酸锰平衡分解率的影响如图所示。图中Y1____Y2(填“>”、“<”或“=”)。
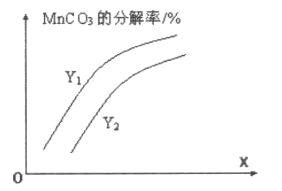
②保持温度不变,将体积扩大至原来的3倍,则容器内压强p(CO2)的变化范围为_______。
③若温度不变,将容器体积压缩至原来的一半,达到新平衡时,与原平衡状态相比,下列物理量一定不变的是________ (填字母)
A.CO2的质量 B. MnCO3的质量 C.MnCO3的分解率
D.化学平平衡常数 E.CO2的物质的量浓度
(3)在4L恒容密闭容器中,充入足量量的MnCO3(s)和a molO2(g),在一定温度下发生反应:MnCO3(s)+O2(g) ![]() 2MnO2(s)+2CO2(g),经过5min该反应刚好达到平衡状态,且该段时间内CO2的化学反应速率为0.2molL-1·min-1若该条件该反应的化学平衡常数K=0.5,则a=____。
2MnO2(s)+2CO2(g),经过5min该反应刚好达到平衡状态,且该段时间内CO2的化学反应速率为0.2molL-1·min-1若该条件该反应的化学平衡常数K=0.5,则a=____。
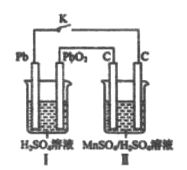
(4)现以铅蓄电池为电源,用石墨为电极,电解MnSO4和H2SO4混合液来制备MnO2,装置如图所示,阳极的电极反应式为___________,当蓄电池中有2mol H+被消耗时,则理理论上能生成MnO2________g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com