
【题目】下列化学反应既属于氧化还原反应又属于吸热反应的是
A.铝片和稀盐酸反应B.氢氧化钡晶体和氯化铵反应
C.灼热的碳与CO2反应D.甲烷在氧气中燃烧。
 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种性能优异的新型材料,在许多领域有广泛应用,前景广阔。某化学小组模拟工业制氮化铝原理,欲在实验室制备氮化铝并检验其纯度。
查阅资料:①实验室用饱和NaNO2与NH4Cl溶液共热制N2:NaNO2+NH4Cl![]() NaCl+N2↑+2H2O。
NaCl+N2↑+2H2O。
②工业制氮化铝:Al2O3+3C+N2![]() 2AlN+3CO,氮化铝在高温下能水解。
2AlN+3CO,氮化铝在高温下能水解。
③AlN与NaOH饱和溶液反应:AlN+NaOH+H2O![]() NaAlO2+NH3↑。
NaAlO2+NH3↑。
Ⅰ.氮化铝的制备
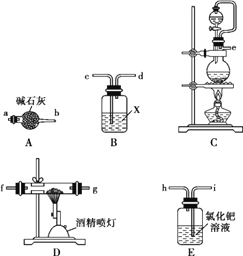
(1)实验中使用的装置如上图所示,请按照氮气气流方向将各仪器接口连接:e→c→d→____________(根据实验需要,上述装置可使用多次)。
(2)B装置内的X液体可能是____;E装置内氯化钯溶液的作用可能是_______。
Ⅱ.氮化铝纯度的测定
【方案ⅰ】甲同学用下图装置测定AlN的纯度(部分夹持装置已略去)。
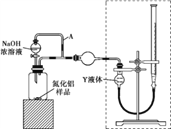
(3)为准确测定生成气体的体积,量气装置(虚线框内)中的Y液体可以是____。
a.CCl4 b.H2O c.NH4Cl饱和溶液 d.植物油
(4)若装置中分液漏斗与导气管之间没有导管A连通,对所测AlN纯度的影响是____ (填“偏大”“偏小”或“不变”)。
【方案ⅱ】乙同学按以下步骤测定样品中AlN的纯度。
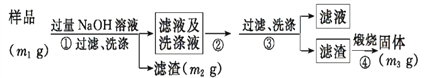
(5)步骤②的操作是_________。
(6)实验室里煅烧滤渣使其分解,除了必要的热源和三脚架以外,还需要的仪器有______等。
(7) 样品中AlN的纯度是__________(用m1、m2、m3表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其合金是人类最早使用的金属材料,铜的化合物在现代生活和生产中有着广泛的应用。
(1)请写出铜的基态原子核外电子排布式:___________。
(2)铜的熔点比钙的高,其原因是____________。
(3)金属铜的堆积方式为下图中的______(填字母序号)。

(4)科学家通过 X 射线推测,胆矾的结构如下图所示。

胆矾的阳离子中心原子的配位数为______,阴离子的空间构型为_______。胆矾中所含元素的电负性从大到小的顺序为_________(用元素符号作答)。
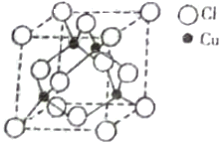
(5)铜与Cl原子构成晶体的晶胞结构如右图所示,该晶体的化学式为______,已知该晶体的密度为 4.14g/cm3,则该晶胞的边长为_______pm(写计算式)。将该物质气化后实验测定其蒸汽的相对分子质量为 198,则其气体的分子式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20m1某稀Ba(OH)2溶液中滴入浓度为0.1mol/L的醋酸。溶液中由水电离出的氢氧根离子浓度随滴入醋酸的体积变化如图,下列分析正确的是

A. 稀Ba(OH)2溶液的浓度为0.1molL-1
B. C点溶液的PH=a
C. D点溶液中C(OH-)<C(H+)+C(CH2COOH)
D. E点溶液中存在C(CH2COO-)>C(Ba2+)>C(OH-)>C(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学工业中Mn可用作氧化剂、助燃剂、活性电极材料、催化剂、油漆和油墨的干燥剂等,碳酸锰矿可作为制备MnO2原料
(1)已知25℃,101kPa时有如下的三个热化学方程式
①MnCO3(s) ![]() MnO(s)+CO2(g) △H1=+116 6kJ/mol
MnO(s)+CO2(g) △H1=+116 6kJ/mol
②2MnO(s)+O2(g) ![]() 2MnO2(s) △H2=-272.0kJ/mol
2MnO2(s) △H2=-272.0kJ/mol
③2MnCO3(s)+O2(g) ![]() 2Mn2(s)+2CO2(g) △H3
2Mn2(s)+2CO2(g) △H3
则△H3=_________;反应②在________条件下(填“高温”、“低温”或“任何温度”)能自发进行。
(2)在密闭容器中投入足量的 MnCO3,在一定条件下发生反应:MnCO3(s) ![]() Mno(s)+CO2(g) △H1=+116.6kJ/mol。一定温度下,达到平衡状态时p(CO2)=bMPa
Mno(s)+CO2(g) △H1=+116.6kJ/mol。一定温度下,达到平衡状态时p(CO2)=bMPa
①温度、压强对碳酸锰平衡分解率的影响如图所示。图中Y1____Y2(填“>”、“<”或“=”)。
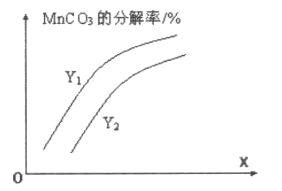
②保持温度不变,将体积扩大至原来的3倍,则容器内压强p(CO2)的变化范围为_______。
③若温度不变,将容器体积压缩至原来的一半,达到新平衡时,与原平衡状态相比,下列物理量一定不变的是________ (填字母)
A.CO2的质量 B. MnCO3的质量 C.MnCO3的分解率
D.化学平平衡常数 E.CO2的物质的量浓度
(3)在4L恒容密闭容器中,充入足量量的MnCO3(s)和a molO2(g),在一定温度下发生反应:MnCO3(s)+O2(g) ![]() 2MnO2(s)+2CO2(g),经过5min该反应刚好达到平衡状态,且该段时间内CO2的化学反应速率为0.2molL-1·min-1若该条件该反应的化学平衡常数K=0.5,则a=____。
2MnO2(s)+2CO2(g),经过5min该反应刚好达到平衡状态,且该段时间内CO2的化学反应速率为0.2molL-1·min-1若该条件该反应的化学平衡常数K=0.5,则a=____。
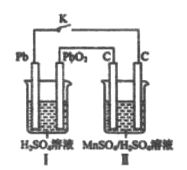
(4)现以铅蓄电池为电源,用石墨为电极,电解MnSO4和H2SO4混合液来制备MnO2,装置如图所示,阳极的电极反应式为___________,当蓄电池中有2mol H+被消耗时,则理理论上能生成MnO2________g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】试样X由氧化亚铁和氧化铜组成.取质量相等的两份试样按下图所示进行实验: 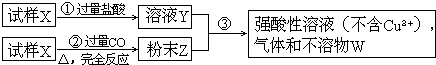
(1)请写出步骤③中所发生的全部反应的离子方程式.
(2)若全部的溶液Y和全部的粉末Z充分反应后,生成的不溶物W的质量是m,则每份试样X中氧化铜的质量为 . (用m表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学一一选修修5:有机化学基础】光刻胶是一种应用广泛的光敏材料,它的一种合成路线如下(部分试剂和产物略去):
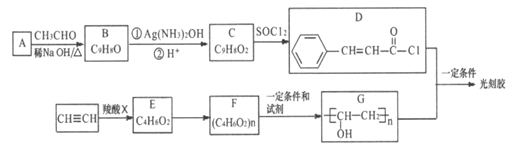
已知:
I.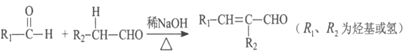
II.![]()
回答下列问题
(1)C中所含官能团的名称是________,G的化学名称为_______________。
(2)乙快和羧酸X加成生成E,E的核磁共振氢谱为三组峰,且峰面积比为3:2:1,E能发生水解反应,则E的结构简式为_________,E→F的反应类型是___________。
(3)B与Ag(NH3)2OH反应的化学方程式为_________________。
(4)D+G→光刻胶的化学方程式_________________________________。
(5)某芳香族有机物H是C的同系物,相对分子质量比C大14,则该有机物H的苯环上只含有两条侧链的同分异构体有______________种。(不考虑立体异构)
(6)根据已有知识并结合相关信息,写出以CH2CH2OH为原料制备CH2CH2CH2COOH的合成路线流程图(无机试剂任用) ______________________。合成路线流程图示例如下:

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯、玉米淀粉等发酵制得。A的钙盐是人们喜爱的补钙剂之一。A在某种催化剂的存在下被氧化,其产物不能发生银镜反应。在浓硫酸存在下, A可发生如下所示的反应。

(1)A含有的官能团名称为_____________________,A→F的反应类型为 __________。
(2)写出一种和B具有相同官能团的同分异构体的结构简式___________________________。
(3)写出A→D的化学方程式_______________________________________________________。
(4)有机物C3H6O含有醛基,一定条件下和H2反应生成CH3CH2CH2OH。检验该有机物是否完全转化的操作是_______________________________________________________________。
(5)有机物E可以由CH2=CHCH2OH得到,改变条件它也可以制得其他产物。设计一条由CH2=CHCH2OH合成CH3CH2COOH的路线_____________。
合成路线流程图示例如下:CH3CH2OH![]() CH2=CH2
CH2=CH2![]()
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com