
【题目】某兴趣小组的同学为了制备氯气并探究其性质,回答下列问题。
Ⅰ.写出实验室制取氯气的离子方程式:_______________________________
Ⅱ.甲同学设计如图所示装置研究氯气能否与水发生反应.气体a是含有少量空气和水蒸气的氯气.请回答下列问题:

(1)浓硫酸的作用是___________________。
(2)证明氯气和水反应的实验现象为__________。
(3)ICl的性质与Cl2类似,写出ICl与水反应的化学方程式是______________________。
(4)若将氯气通入石灰乳制取漂白粉,反应的化学方程式是______________________。漂白粉溶于水后,遇到空气中的CO2,即产生漂白、杀菌作用,反应的化学方程式是_________________。
【答案】MnO2+4H++2Cl—=Mn2++Cl2 ↑+2H2O 干燥氯气 干燥的有色布条不褪色,湿润的有色布条褪色 ICl+H2O == HCl+HIO 2Cl2+2Ca(OH)2 ==CaCl2+Ca(ClO)2 +2H2O Ca(ClO)2 +CO2+ H2O==CaCO3 ↓+2HClO
【解析】
Ⅰ.二氧化锰与浓盐酸反应生成氯化锰、氯气和水;
Ⅱ.(1)浓硫酸具有吸水性,常用作干燥剂;
(2)干燥氯气不具有漂白性,氯气和水反应生成盐酸和次氯酸;
(3)ICl的性质与Cl2类似,其中碘的非金属性弱于氯,碘显+1价,氯显-1价,ICl与水反应生成HIO和HCl;
(4)氯气和石灰乳反应生成氯化钙、次氯酸钙和水;
漂白粉溶于水后,遇到空气中的CO2,反应产生次氯酸。
Ⅰ.二氧化锰与浓盐酸反应生成氯化锰、氯气和水,反应的离子方程式为:MnO2+4H++2Cl—=Mn2++Cl2 ↑+2H2O;
Ⅱ.(1)浓硫酸具有吸水性,常用作干燥剂,在实验中吸收气体a中的水蒸气;
(2)干燥氯气不具有漂白性,氯气和水反应生成盐酸和次氯酸,方程式为:Cl2+H2O=HCl+HClO,次氯酸具有漂白性,故答案为:干燥的有色布条不褪色,湿润的有色布条褪色;
(3)ICl的性质与Cl2类似,其中碘的非金属性弱于氯,碘显+1价,氯显-1价,ICl与水反应生成HIO和HCl,反应的化学方程式是ICl+H2O == HCl+HIO;
(4)氯气和石灰乳反应生成氯化钙、次氯酸钙和水,反应方程式为2Cl2+2Ca(OH)2 ==CaCl2+Ca(ClO)2 +2H2O;
漂白粉溶于水后,遇到空气中的CO2,反应产生次氯酸,即产生漂白、杀菌作用,反应的化学方程式是Ca(ClO)2 +CO2+ H2O==CaCO3 ↓+2HClO。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】某同学利用右图实验装置探究盐桥式原电池的工作原理,盐桥中除添加琼脂外,还要添加KCl的饱和溶液。下列叙述正确的是( )

A. 导线中电子流向为b→a
B. 电池工作时,电流方向a→b
C. 电池工作时,盐桥中的K+向右侧烧杯移动,Cl-向左侧烧杯移动
D. 电池工作时,盐桥中的K+向左侧烧杯移动,Cl-向右侧烧杯移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2SO2(g)+O2(g) ![]() 2SO3(g) △H=Q(Q<0),向同温、同体积的三个真空密闭容器中分别充入气体:(甲)2molSO2和1molO2;(乙)1molSO2 和0.5molO2;(丙)2molSO3;恒温、恒容下反应达平衡时,下列关系一定正确的是( )
2SO3(g) △H=Q(Q<0),向同温、同体积的三个真空密闭容器中分别充入气体:(甲)2molSO2和1molO2;(乙)1molSO2 和0.5molO2;(丙)2molSO3;恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A. 容器内压强p:p甲=p丙<2p乙
B. SO3的质量m:m甲=m丙<2m乙
C. c(SO2)与c(O2)之比k:k甲=k丙>2k乙
D. 反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究过氧化钠的强氧化性,某小组设计了如图所示的实验装置。

实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,A中剧烈反应,有黄绿色气体产生。
③待产生连续气泡后,将装置D中的导管末端伸入集气瓶中,收集到无色气体。
④反应一段时间后,关闭分液漏斗的活塞,再通一段时间N2,直至装置中气体变为无色。
回答下列问题:
(1)装置D中收集的无色气体能使带火星的木条复燃,据此推断该气体是_______,解释产生该气体的原因是(用化学方程式表示)____________________________。
(2)装置B中湿润的淀粉碘化钾试纸变蓝。甲同学根据A中气体的颜色推测试纸变蓝时发生的反应可能是(写离子方程式)____________________________;乙同学认为使试纸变蓝的原因也可能是____________________________。
(3)资料显示,Na2O2与干燥的HCl能发生化学反应生成Cl2,该反应的化学方程式为:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知还原性Cl﹣<Fe2+<H2O2<I﹣<SO2,判断下列反应不能发生的是( )
A. 2Fe3++SO2+2H2O═SO42﹣+4H++2Fe2+
B. I2+SO2+2H2O═H2SO4+2HI
C. H2O2+2H++SO42﹣═SO2+O2+2H2O
D. 2Fe3++2I﹣═2Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下能量关系示意图,下列说法正确的是

A. 1 mol C(g)与1 mol O2(g)的能量之和为393.5 kJ
B. 反应2CO(g)+O2(g) ==2CO2(g)中,生成物的总能量大于反应物的总能量
C. 由C→CO的热化学方程式为:2C(s)+O2(g) ==2CO(g) ΔH= 221.2 kJmol1
D. 热值指一定条件下单位质量的物质完全燃烧所放出热量,则CO热值ΔH= 10.1 kJmol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果.设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,
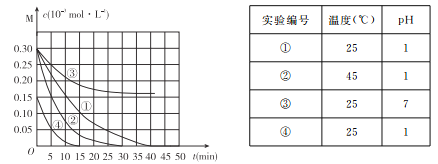
下列说法不正确的是
A. 实验①在15 min内M的降解速率为1.33×10-5mol/(L·min)
B. 若其他条件相同,实验①②说明升高温度,M降解速率增大
C. 若其他条件相同,实验①③证明pH越高,越不利于M的降解
D. 实验④说明M的浓度越小,降解的速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所给信息,得出的结论正确的是( )
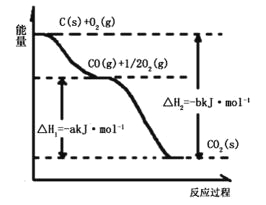
A.碳的燃烧热为bkJ/mol
B.2C(s)+O2(g)=2CO(g)△H=-2(b-a)kJ/mol
C.2CO2(s)=2CO(g)+O2(g)△H=+akJ/mol
D.C(s)+O2(g)=CO2(g)△H<-bkJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把NaHCO3作为发酵粉使用时,往往加入少量的明矾,这是因为明矾
A. 在水中能起到酸的作用B. 受热分解能放出气体
C. 具有净水剂的作用D. 能起催化剂的作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com