
【题目】根据如下能量关系示意图,下列说法正确的是

A. 1 mol C(g)与1 mol O2(g)的能量之和为393.5 kJ
B. 反应2CO(g)+O2(g) ==2CO2(g)中,生成物的总能量大于反应物的总能量
C. 由C→CO的热化学方程式为:2C(s)+O2(g) ==2CO(g) ΔH= 221.2 kJmol1
D. 热值指一定条件下单位质量的物质完全燃烧所放出热量,则CO热值ΔH= 10.1 kJmol1
【答案】C
【解析】A、由图可知:1molC(s)与1molO2(g)的能量之和大于393.5kJ,而1molC(g)与1molO2(g)的能量之和远大于393.5kJ,故A错误;B、由图可知:1molCO(g)和0.5mol的O2(g)生成1molCO2(g)放出282.9kJ的热量,所以反应2CO(g)+O2(g)═2CO2(g)中,反应物的总能量大于生成物的总能量,故B错误;C、由图可知:1molC(s)和0.5molO2(g)转化为1mol的CO(g),放出热量为:393.5-282.9=110.6kJ,所以2C(s)+O2(g)═2CO(g)△H=-221.2kJ/mol,故C正确;D、热值指在一定条件下单位质量的物质完全燃烧所放出的热量,燃烧产物在该条件下是一种较为稳定的状态,则CO的热值为![]() kJ/g=10.1kJ/g,单位不正确,故D错误;故选C。
kJ/g=10.1kJ/g,单位不正确,故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中可逆反应mA(g)+nB(g)![]() pC(g)+qQ(g) 当m、n、p、q为任意整数时,达到平衡的标志是
pC(g)+qQ(g) 当m、n、p、q为任意整数时,达到平衡的标志是
①体系的压强不再改变
②体系的温度不再改变
③各组分的浓度不再改变
④各组分的质量分数不再改变
⑤反应速率v(A):v(B):v(C):v(D) =m:n:p:q
⑥单位时间内m mol A断键反应,同时pmol C也断键反应
A. ③④⑤⑥ B. ②③④⑥ C. ①③④⑤ D. ①③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 无色透明溶液中: Zn2+、SO42-、NH4+,Cl-
B. 0.1mol/L NaHCO3溶液中: Mg2+、Al3+、K+、NO3-
C. 能使甲基橙变黄的溶液中: Na+,CH3COO-、 MnO4-、 Fe3+
D. c(H+)/c(OH-)=1×1012的溶液中:NO3-、I-、K+、Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量氯化钡溶液反应,若生成硫酸钡沉淀的质量比为1∶2∶3,则三种硫酸盐的物质的量浓度之比为( )
A. 1∶2∶3 B. 1∶6∶9 C. 1∶3∶3 D. 1∶3∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学为了制备氯气并探究其性质,回答下列问题。
Ⅰ.写出实验室制取氯气的离子方程式:_______________________________
Ⅱ.甲同学设计如图所示装置研究氯气能否与水发生反应.气体a是含有少量空气和水蒸气的氯气.请回答下列问题:

(1)浓硫酸的作用是___________________。
(2)证明氯气和水反应的实验现象为__________。
(3)ICl的性质与Cl2类似,写出ICl与水反应的化学方程式是______________________。
(4)若将氯气通入石灰乳制取漂白粉,反应的化学方程式是______________________。漂白粉溶于水后,遇到空气中的CO2,即产生漂白、杀菌作用,反应的化学方程式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某实验小组为探究ClO-、I2、SO![]() 在酸性条件下的氧化性强弱,设计实验如下:
在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉-碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4 mL 0.5 mol·L-1的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式:__________________________。
(2)实验②的化学反应中转移电子的物质的量是___________________。
(3)以上实验说明,在酸性条件下ClO-、I2、SO![]() 的氧化性由弱到强的顺序是________________。
的氧化性由弱到强的顺序是________________。
Ⅱ.(4)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是________(填序号)。
A.Cl2 B.H2O2
C.ClO2 D.O3
(5)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是_______________________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCN是重要的基本化工原料,常用于基本化学合成、冶金等,回答下列问题:
(1)NaCN中C的化合价为_____;写出NaCN的电子式:_________________________________;
(2)现代开采金矿:先以NaCN溶液浸取粉碎的含金(Au)矿石,得到 Na[Au(CN)2](二氰合金酸钠)溶液;再用锌与Na[Au(CN)2]溶液发生置换反应生成金。“粉碎”的目的是______________;“浸取”反应的氧化剂是______________;消耗的锌与生成的金的物质的量之比为___________。
(3)工业上常用纯碱、焦炭、氨气反应制备NaCN,写出反应的化学方程式,并用单线桥标明电子转移的方向和数目:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中不同的化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )
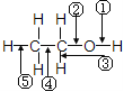
A. 和金属钠作用时,键①断裂
B. 和浓H2SO4共热至170℃时,键②和⑤断裂
C. 和浓H2SO4共热至140℃时,键③⑤断裂
D. 在Ag催化剂下和O2反应时,键①和③断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A. 相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡时,c(PCl5) > 0.4mol·L-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol·L-1,则反应的△H<0
C. 反应在前50 s的平均速率为v(PCl3)=0.0032mol·L-1·s-1
D. 相同温度下,起始时向容器中充入2.0mol PCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com