
分析 ㈠中性时,二者以2:1反应生成硫酸钡、硫酸钠、水;在以上中性溶液中,继续滴加Ba(OH)2溶液,反应生成硫酸钡和水;
㈡少量的氢氧化钙Ca(OH)2溶液完全反应,生成碳酸钙、碳酸钠和水;
㈢碳酸氢钠NaHCO3溶液完全反应,生成碳酸钠、水、NaOH.
解答 解:㈠中性时,二者以2:1反应生成硫酸钡、硫酸钠、水,发生的离子反应为2H++2OH-+Ba2++SO42-═BaSO4↓+2H2O;在以上中性溶液中,继续滴加Ba(OH)2溶液,硫酸根离子沉淀完全,反应生成硫酸钡和水,发生的离子反应为Ba2++SO42-═BaSO4↓,故答案为:2H++2OH-+Ba2++SO42-═BaSO4↓+2H2O;Ba2++SO42-═BaSO4↓;
㈡少量的氢氧化钙Ca(OH)2溶液完全反应,生成碳酸钙、碳酸钠和水,离子反应为Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O,故答案为:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O;
㈢碳酸氢钠NaHCO3溶液完全反应,生成碳酸钠、水、NaOH,离子反应为Ca2++OH-+HCO3-=CaCO3↓+H2O,故答案为:Ca2++OH-+HCO3-=CaCO3↓+H2O.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重与量有关的离子反应考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | Ca(OH)2 |
| ② | HCl | CO2 | Ca(OH)2 |
| ③ | CO2 | SO3 | Ba(NO3)2 |
| ④ | NO2 | SO2 | BaCl2 |
| ⑤ | CO2 | NH3 | CaCl2 |
| ⑥ | O2 | NH3 | MgCl2 |
| A. | ①②⑤ | B. | ①③⑤⑥ | C. | ①②④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
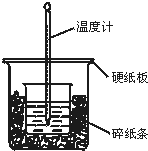 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 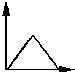 | B. | 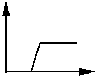 | C. | 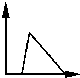 | D. | 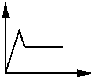 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
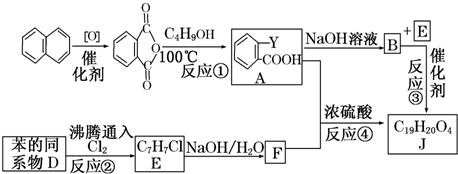
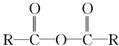 $\stackrel{R′OH}{→}$
$\stackrel{R′OH}{→}$ +
+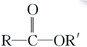
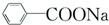 +RCl→
+RCl→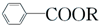 +NaCl
+NaCl .
.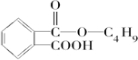 +
+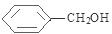 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$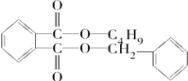 +H2O.
+H2O.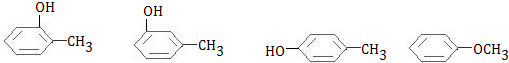 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com