
【题目】已知下列热化学方程式:
① H2(g)+1/2O2(g)=H2O(l) ΔH=-285 kJ/mol
② H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ/mol
③ C(s)+1/2O2(g)=CO(g) ΔH=-241.8 kJ/mol
④ C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
回答下列各问题:
(1)上述反应中属于放热反应的是_______________。
(2)H2的燃烧热为____________________;C的燃烧热为__________________。
(3)燃烧10 g H2生成液态水,放出的热量为___________________。
(4)CO的燃烧热为_________________;其热化学方程式为___________________。
【答案】①②③④285 kJ/mol393.5 kJ/mol1425 kJ151.7 kJ/molCO(g)+1/2O2(g)===CO2(g);ΔH=-151.7 kJ/mol
【解析】
(1)热化学方程式中△H为负值的反应为放热反应,△H为正值的为吸热反应:①H2(g)+![]() O2(g)=H2O(l)△H=-285kJmol-1,②H2(g)+
O2(g)=H2O(l)△H=-285kJmol-1,②H2(g)+ ![]() O2(g)=H2O(g)△H=-241.8kJmol-1,③C(s)+
O2(g)=H2O(g)△H=-241.8kJmol-1,③C(s)+ ![]() O2(g)=CO(g)△H=-110.5kJmol-1,④C(s)+O2(g)=CO2(g)△H=-393.5kJmol-1,以上4个反应均为放热反应,故答案为:①②③④;
O2(g)=CO(g)△H=-110.5kJmol-1,④C(s)+O2(g)=CO2(g)△H=-393.5kJmol-1,以上4个反应均为放热反应,故答案为:①②③④;
(2)1mol纯净物完全燃烧生成稳定的氧化物所放出的热量为燃烧热,H2的燃烧热为285kJmol-1,C的燃烧热为393.5kJ/mol,故答案为:285kJmol-1;393.5kJ/mol;
(3)依据反应①进行计算燃烧10gH2生成液态水放出的热量;
H2(g)+ ![]() O2(g)=H2O(l)△H=-285.8kJmol-1
O2(g)=H2O(l)△H=-285.8kJmol-1
2g 285kJ
10g Q
Q=![]() =1425kJ,故答案为:1425kJ;
=1425kJ,故答案为:1425kJ;
(4)③ C(s)+1/2O2(g)=CO(g) ΔH=-241.8 kJ/mol,④ C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol,根据盖斯定律,将④-③得:CO(g)+1/2O2(g)===CO2(g);ΔH=-151.7 kJ/mol,故答案为:151.7 kJ/mol;CO(g)+1/2O2(g)===CO2(g);ΔH=-151.7 kJ/mol。


科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是一种常见化学电源,其原理反应:2H2+O2=2H2O,其工作示意图如图。下列说法不正确的是( )
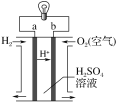
A.a极是负极,发生反应为H2-2e-=2H+
B.b电极上发生还原反应,电极反应式为O2+4H++4e-=2H2O
C.电解质溶液中H+向正极移动
D.放电前后电解质溶液的pH不会发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年国际计量大会将摩尔的定义修改为:1摩尔包含6.02214076×1023个基本单元,这一常数被称为阿伏加德罗常数(NA),通常用6.02×1023mol-1表示,新定义于2019年5月20日正式生效。下列说法不正确的是( )
A.标准状况下,22.4L的NH3约含有17×6.02×1023个质子
B.白磷分子(P4)呈正四面体结构,62g白磷中约含有3×6.02×1023个P-P键
C.标准状况下,18gH2O中约含有2×6.02×1023个氢原子
D.由新定义可知,阿伏加德罗常数表达为NA=6.02214076×1023 mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解饱和食盐水(含少量Ca2+、Mg2+)并进行相关实验,电解一段时间后,各部分装置及对应的现象如下:

对应现象 | (1)中黑色固体变红 | (2)电极a附近溶液出现浑浊 | (3)中溶液出现浑浊 | (4)中溶液红色褪去 |
下列对实验现象解释不正确的是( )
A.(1)中:CuO+H2![]() Cu+H2O
Cu+H2O
B.(2)中a电极:2H2O+2e-=H2↑+2OH-,Mg2++2OH-=Mg(OH)2↓
C.(3)中:Cl2+S2-=S↓+2Cl-
D.(4)中:Cl2+H2O![]() HCl + HClO
HCl + HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、F为原子序数依次增大的五种短周期主族元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B单质在D单质中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A单质在F单质中燃烧,产物溶于水得到一种强酸。用相应的化学用语回答下列问题:
(1)F在周期表中的位置是___,E2D2的电子式为___。
(2)AFD的结构式为___,BD2的电子式为___。
(3)EDA的电子式为___,AF的电子式为___。
(4)B元素形成的化合物种类繁多的原因可能是(填序号)___。
①碳原子之间成键方式多样化,碳碳之间可以单键、双键或者叁键
②同分异构现象的普遍存在
③碳碳之间可以通过共价键彼此结合成链状或者环状
(5)元素D、E、F形成的简单离子的半径由大到小为__(用离子符号表示)。
(6)用电子式表示E与F形成化合物的过程___。
(7)写出E与D形成的既含离子键又含共价键的化合物与水反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制氨气的装置图,请回答:
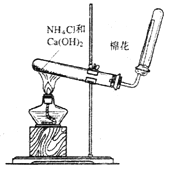
(1)收集氨气用__法;
(2)实验室制取氨气的化学反应方程式:__;
(3)干燥氨气可选用__;
(4)如何检验氨气是否收集满:__;
(5)实验装置中棉花的作用是:__;
(6)制取出来的氨气可以遇到一种挥发出来的气体冒出大量白烟,且产生晶体,写出化学反应方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组按下列路线合成镇痛药哌替啶M。

已知:ⅰ.R—NH2+![]()
![]() RNHCH2CH2OH
RNHCH2CH2OH
ⅱ.![]()
(1)A→B的化学方程式是__。
(2)B→C的反应类型是__。
(3)D的核磁共振氢谱只有一个吸收峰,其结构简式是__。
(4)D→E的化学方程式是__。
(5)G中含有两个六元环,其结构简式是__。
(6)I和H反应生成镇痛药哌替啶M的化学方程式是__。
(7)写出同时符合下列条件的C的同分异构体的结构简式__(写出一种即可)。
①分子中有苯环且是苯的邻位二取代物;
②核磁共振氢谱表明分子中有6种氢原子;红外光谱显示存在碳氮双键(C=N)。
(8)以C为原料可以合成重要的医药中间体对氨基苯乙酸,合成路线如下:
![]()
①写出Y的结构简式__。
②合成路线中反应条件Fe/HCl的作用是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子是
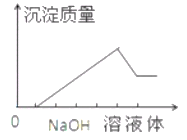
A. Mg2+、Al3+、Fe3+ B. H+、Mg2+、Al3+
C. H+、Ba2+、Al3+ D. 只有Mg2+、Al3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com