

分析 固体组成的混合物溶于足量水后,再加入盐酸时,0-A时沉淀的质量不变,说明溶液中NaOH过量,加入10 mL 盐酸恰好中和过量的NaOH,再加盐酸沉淀增多,说明[Al(OH)4]-转化为Al(OH)3,故A点沉淀物为 Mg(OH)2,AB段发生反应:[Al(OH)4]-+H+=Al(OH)3↓+H2O,B点溶液中存在的溶质是NaCl,沉淀为Mg(OH)2、Al(OH)3,B点后发生反应:Al(OH)3+3H+=Al3++3H2O、Mg(OH)2+2H+=Mg2++2H2O;
由AB段消耗盐酸,结合反应方程式、Al原子守恒计算n(AlCl3),B点溶液中存在的溶质是氯化钠,根据原子守恒可知n(NaOH)=n(NaCl),则原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl).
解答 解:固体组成的混合物溶于足量水后,再加入盐酸时,0-A时沉淀的质量不变,说明溶液中NaOH过量,加入10 mL 盐酸恰好中和过量的NaOH,再加盐酸沉淀增多,说明[Al(OH)4]-转化为Al(OH)3,故A点沉淀物为 Mg(OH)2,AB段发生反应:[Al(OH)4]-+H+=Al(OH)3↓+H2O,B点溶液中存在的溶质是NaCl,沉淀为Mg(OH)2、Al(OH)3,B点后发生反应:Al(OH)3+3H+=Al3++3H2O、Mg(OH)2+2H+=Mg2++2H2O.
(1)由上述分析可知,A为Mg(OH)2,因为加入10 mL 盐酸恰好中和过量的NaOH,再加盐酸沉淀增多,说明[Al(OH)4]-转化为Al(OH)3,故A点沉淀物为 Mg(OH)2,
故答案为:Mg(OH)2;
(2)由上述分析可知,A点至B点发生反应的离子方程式为:[Al(OH)4]-+H+=Al(OH)3↓+H2O,
故答案为:[Al(OH)4]-+H+=Al(OH)3↓+H2O;
(3)AB段发生反应:[Al(OH)4]-+H+=Al(OH)3↓+H2O,则n[Al(OH)3]=n(HCl)=1mol/L×(0.03-0.01)L=0.02mol,根据铝原子守恒得n(AlCl3)=n[Al(OH)3]=0.02mol,氯化铝的质量为:0.02mol×133.5g/mol=2.67g;
A点沉淀的是氢氧化镁,则n(Mg(OH)2)=$\frac{1.16g}{58g/mol}$=0.02mol,根据Mg原子守恒得n(MgCl2)=n[Mg(OH)2]=0.02mol,B点溶液中存在的溶质是NaCl,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.02mol×2+0.02mol×3+0.03L×1mol/L=0.13mol,则原混合物中NaOH的质量是:40g/mol×0.13mol=5.20g;
C点n(NaCl)=0.13mol,根据质量守恒可知C点(此时沉淀恰好完全溶解)HCl溶液的体积为:$\frac{0.13mol}{1mol/L}$=0.13L=130mL,
故答案为:2.67;0.13.
点评 本题考查了混合物反应的计算,题目难度中等,明确曲线变化趋势及每段发生的化学反应为解本题关键,注意掌握守恒法在化学计算中的应用.


科目:高中化学 来源: 题型:选择题
| A. | 维生素C具有还原性,能在人体内起抗氧化作用 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 糖类是产生能量最高的营养物质 | |
| D. | 废电池必须进行集中处理的首要原因是回收利用石墨电极和金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | I A | IIA | IIIA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 四 | ⑨ | ⑩ |
 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
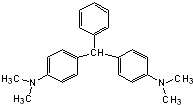 无色孔雀石绿(结构简式如图所示)曾被用作水产养殖业的杀虫剂(鱼药),因为具有潜在致癌性,已被禁止使用.下列关于无色孔雀石绿的叙述中,正确的是( )
无色孔雀石绿(结构简式如图所示)曾被用作水产养殖业的杀虫剂(鱼药),因为具有潜在致癌性,已被禁止使用.下列关于无色孔雀石绿的叙述中,正确的是( )| A. | 分子中所有的碳原子可能在同一平面上 | |
| B. | 无色孔雀石绿属于烃 | |
| C. | 无色孔雀石绿可与溴水中的溴发生加成反应 | |
| D. | 在一定条件下,1mol无色孔雀石绿可以和9mol氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
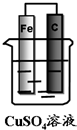 如图装置能否形成原电池?若能,分别写出原电池的电极反应式.
如图装置能否形成原电池?若能,分别写出原电池的电极反应式. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先加BaCl2,再加入HCl | B. | 先加HNO3,再加BaCl2 | ||
| C. | 先加H2SO4,再加BaCl2 | D. | 先加HCl,再加BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌 | |
| B. | 可用酒精萃取碘水中的I2 | |
| C. | 在碘水中加入几滴淀粉溶液,溶液变蓝色 | |
| D. | 含I-的滤液中加入稀硫酸和双氧水后,碘元素发生还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com