
| 族 周期 | I A | IIA | IIIA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 四 | ⑨ | ⑩ |
 ;
; ;
;分析 由元素在周期表中位置,可知①为C、②为N、③为F、④为Mg、⑤为Al、⑥为Si、⑦为Cl、⑧为Ar,⑨为K、⑩为Br.
(1)⑩是Br元素,原子核内有35个质子,核外有4个电子层,各层电子数为2、8、18、7;
(2)与④形成化合物是MgF2,属于离子化合物,Mg失去2个电子成为镁离子,F得到1个电子成为氟离子;
(3)①的单质和⑥的氧化物反应即C与二氧化硅高温下发生置换反应生成Si与CO;
(4)⑤是Al,氢氧化铝与氢氧化钡溶于反应生成偏铝酸钡与水,氢氧化铝是难溶物,书写离子方程式时不能拆开;
(5)甲烷与氧气燃烧的化学方程式为:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O,根据反应热=反应物键能之和-生成物键能之和,据此计算该反应反应热进行解答;
(6)燃料电池中,负极上燃料失电子发生氧化反应.
解答 解:由元素在周期表中位置,可知①为C、②为N、③为F、④为Mg、⑤为Al、⑥为Si、⑦为Cl、⑧为Ar,⑨为K、⑩为Br.
(1)⑩是Br元素,原子核内有35个质子,原子结构示意图为 ,
,
故答案为: ;
;
(2)③与④形成化合物是MgF2,属于离子化合物,Mg失去2个电子成为镁离子,F得到1个电子成为氟离子,用电子式表示其形成过程是: ,
,
故答案为: ;
;
(3)①的单质和⑥的氧化物反应即C与二氧化硅高温下发生置换反应,化学方程式为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(4)⑤是Al,铝的氢氧化物为氢氧化铝,是两性氢氧化物与氢氧化被溶液反应的离子方程式为:Al(OH)3+OH-=AlO-2+2H2O,
故答案为:Al(OH)3+OH-=AlO-2+2H2O;
(5)甲烷与氧气燃烧的化学方程式为:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O,根据反应热与化学键键能的关系,△H=(4×414+2×498-2×728-2×2×464)kJ/mol=-660 kJ/mol,所以1mol甲烷完全燃烧放出660kJ的热量,故答案为:660;
(6)肼--空气碱性燃料电池中,负极上燃料失电子和氢氧根离子反应生成氮气和水,电极反应式为N2H4-4e-+4OH-═N2+4H2O,
故答案为:N2H4-4e-+4OH-═N2+4H2O.
点评 本题考查元素周期表的应用、元素的性质应用、化学用语的表示、反应热的计算、原电池电极反应书写等,题目难度中等,侧重考查学生对知识的迁移应用,注意掌握用电子式表示化学键或物质的形成.


 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑥ | B. | ①③④⑥ | C. | ②④⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若温度不变,将容器的体积增大一倍,此时的SO2浓度变为原来的0.5倍 | |
| B. | 若平衡时SO2、O2的转化率相等,说明反应开始时,两者的物质的量这比为2:1 | |
| C. | 若从平衡体系中分离出SO3,则有利于提高SO2的转化率和加快正反应速率 | |
| D. | 平衡状态时SO2、O2、SO3的物质的量之比一定为2:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生铁在潮湿的空气中易发生化学腐蚀而锈蚀 | |
| B. | 海水淡化能解决淡水供应危机,向海水中加净水剂明矾可以使海水淡化 | |
| C. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| D. | 在米汤中加入食盐,可以检验食盐中是否加碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,如果要合成
,如果要合成 所用的原始原料可以是( )
所用的原始原料可以是( )| A. | 2,3-二甲基-1,3-丁二烯和1-丁炔 | B. | 2-甲基-1,3-丁二烯和2-丁炔 | ||
| C. | 2,3-二甲基-1,3-戊二烯和乙炔 | D. | 2-甲基-1,3-丁二烯和丙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点HBr>HCl,则同族元素氢化物沸点HCl>HF | |
| B. | Fe3O4可表示为FeO•Fe2O3,则Pb3O4可表示为PbO•Pb2O3 | |
| C. | CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应也只生成Na2SO3和O2 | |
| D. | 因为N元素的非金属性比P元素强,所以HNO3的酸性强于H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
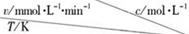 | 0.600 | 0.500 | 0.400 | 0.300 |
| 318.2 | 3.60 | 3.00 | 2.40 | 1.80 |
| 328.2 | 9.00 | 7.50 | a | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
| A. | a=7.50 | |
| B. | 同时改变反应温度和蔗糖的浓度,v可能不变 | |
| C. | b>318.2 | |
| D. | 温度为b时,蔗糖浓度减少一半所需的时间比318.2K时短 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com