
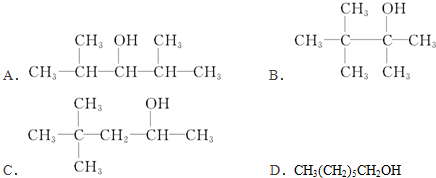
分析 (1)与-OH相连C的邻位C上有H可发生消去反应,可以发生消去反应,生成两种单烯烃,说明与-OH相连的C的两个邻位C上有H,且不具有对称结构;
(2)与-OH相连C上有2个H,可催化氧化生成醛
(3)连接羟基的C原子数不含H原子,则不会被催化氧化;
(4)连接羟基的C原子数含有1个H原子,催化氧化会生成酮;
(5)连接羟基的碳原子上含有H就可以被酸性高锰酸钾溶液氧化.
解答 解:(1)有机物可以发生消去反应,生成两种单烯烃,说明该醇中与-OH相连的C的两个邻位C上有H,且不具有对称结构,满足条件的为C,故答案为:C;
(2)可以发生催化氧化生成醛,说明分子中与-OH相连C上有2个H,满足条件的为:D.CH3(CH2)5CH2OH,故答案为:D;
(3)不能发生催化氧化,说明连接羟基的C原子数不含H原子,满足条件的为:B,故答案为:B;
(4)能被催化氧化为酮,说明连接羟基的C原子数含有1个H原子,满足条件的为:A、C,总共有2种,故答案为:2;
(5)能使酸性KMnO4溶液褪色,说明连接羟基的碳原子上含有H,满足条件的为:A.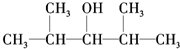 、C.
、C.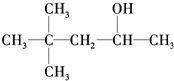 、D.CH3(CH2)5CH2OH,总共有3种,故答案为:3.
、D.CH3(CH2)5CH2OH,总共有3种,故答案为:3.
点评 本题考查有机物结构与性质,为高频考点,侧重醇性质的考查,把握催化氧化、消去反应结构上特点为解答的关键,题目难度不大.


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2A溶液中一定有:c(OH-)=c(H+)+c(HA-) | |
| B. | Na2A溶液呈碱性,NaHA溶液可能酸性可能呈碱性 | |
| C. | Na2A溶液中一定有c(Na+)+c(H+)=c(OH-)+c(A2-)+c(HA-) | |
| D. | NaHA溶液一定有c(Na+)>c(HA)>c(OH-)>c(H2A)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取样,滴加AgNO3溶液,看是否有白色沉淀 | |
| B. | 取样,先加盐酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成 | |
| C. | 取样,加少量AgNO3溶液,有白色沉淀,再加稀HCl,看白色沉淀是否消失 | |
| D. | 取样,加少量AgNO3溶液,有白色沉淀,再加稀HNO3,看白色沉淀是否消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
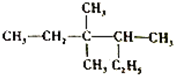
| A. | 2-乙基-3,3-二甲基戊烷 | B. | 3,3,4-三甲基己烷 | ||
| C. | 3,3-甲基-4乙基戊烷 | D. | 2,3,3-三甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
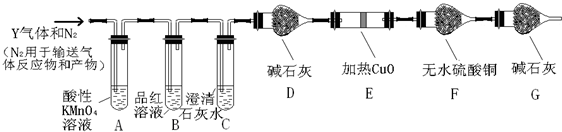
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
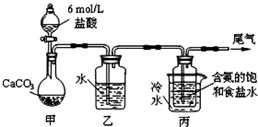 碳酸钠俗称纯碱,在日常生产和生活中有着广泛的应用.某化学兴趣小组想根据所学知识模拟制备碳酸钠,方法如下:先以NaCl、NH3、CO2和水等为原料以及如图所示装置制取NaHCO3(反应的化学方程式为NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl),然后再将NaHCO3制成Na2CO3.
碳酸钠俗称纯碱,在日常生产和生活中有着广泛的应用.某化学兴趣小组想根据所学知识模拟制备碳酸钠,方法如下:先以NaCl、NH3、CO2和水等为原料以及如图所示装置制取NaHCO3(反应的化学方程式为NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl),然后再将NaHCO3制成Na2CO3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO3溶液中:c(H+)+c(HSO3-)+2c(H2SO3)═c(OH-) | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | 有些化学反应既属于复分解反应又属于氧化还原反应 | |
| D. | 常温下,将pH=3的HA和PH=11的BOH等体积混合后pH>7,可能生成了弱酸强碱盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
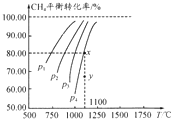 在一容积不变的密闭容器中充入0.1mol/LCO2和0.1mol/LCH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g).测得平衡时CH4的转化率与温度、压强的关系如图.下列有关说法正确的是( )
在一容积不变的密闭容器中充入0.1mol/LCO2和0.1mol/LCH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g).测得平衡时CH4的转化率与温度、压强的关系如图.下列有关说法正确的是( )| A. | 上述反应的△H<0 | |
| B. | 压强P1>P2>P3>P4 | |
| C. | 1100℃时该反应的平衡常数约为1.64 | |
| D. | 压强为P4时,y点的v正<v逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
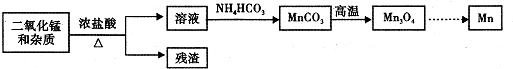
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com