
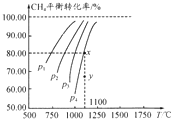
 在一容积不变的密闭容器中充入0.1mol/LCO2和0.1mol/LCH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g).测得平衡时CH4的转化率与温度、压强的关系如图.下列有关说法正确的是( )
在一容积不变的密闭容器中充入0.1mol/LCO2和0.1mol/LCH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g).测得平衡时CH4的转化率与温度、压强的关系如图.下列有关说法正确的是( )| A. | 上述反应的△H<0 | |
| B. | 压强P1>P2>P3>P4 | |
| C. | 1100℃时该反应的平衡常数约为1.64 | |
| D. | 压强为P4时,y点的v正<v逆 |
分析 A、随温度的升高转化率增大;
B、增大压强,平衡向气体体积减小的方向移动;
C、利用三段式计算出平衡时的浓度求算;
D、y点时甲烷的转化率小,平衡正向移动.
解答 解:A、从图象分析,随温度升高转化率增大,正反应吸热,△H>0,故A错误;
B、压强增大,平衡向逆反应方向移动,甲烷的转化率变小,故P4>P3>P2>P1,故B错误;
C、反应 CH4(g)+CO2(g)?2CO(g)+2H2(g),
起始(mol/L) 0.1 0.1 0 0
变化(mol/L) 0.08 0.08 0.16 0.16
平衡(mol/L) 0.02 0.02 0.16 0.16
平衡常数K=$\frac{0.1{6}^{2}×0.1{6}^{2}}{0.02×0.02}$=1.64,故C正确;
D、在y点,甲烷的转化率小于平衡时的转化率,平衡正向移动,V正>V逆,故D错误.
故选C.
点评 本题考查了平衡受温度、压强的影响而移动的问题,注意看准图象是解题的关键,难度中等.


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③⑤ | C. | ②③⑤ | D. | 只有③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 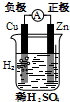 Cu-Zn原电池 | B. |  CuSO4溶液粗铜的精炼 | ||
| C. |  NnCl2溶液铁片镀锌 | D. | 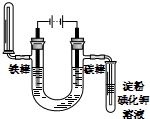 饱和NaCl溶液验证气体产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结 论 | |
| A | 向盛有2mL0.1mol/LAgNO3溶液的试管中,先滴几滴0.1mol/LKCl溶液,再滴加0.1mol/LKI溶液.试管中先出现白色沉淀,后出现淡黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
| C | 在分液漏斗中加入碘水后再加入CCl4,充分振荡,分层,下层溶液呈紫色 | CCl4可作为碘的萃取剂 |
| D | 测定饱和NaClO溶液、CH3COONa溶液的pH,pH(NaClO)>pH(CH3COONa) | 弱酸的酸性:HClO<CH3COOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
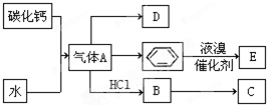
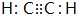 ;D的最简式CH2=CH2;
;D的最简式CH2=CH2; +Br2 $\stackrel{FeBr_{3}}{→}$
+Br2 $\stackrel{FeBr_{3}}{→}$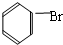 +HBr,其反应类型为取代反应.B→C的化学方程式nCH2=CHCl$\stackrel{催化剂}{→}$
+HBr,其反应类型为取代反应.B→C的化学方程式nCH2=CHCl$\stackrel{催化剂}{→}$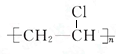 ,其反应类型为加聚反应.
,其反应类型为加聚反应.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
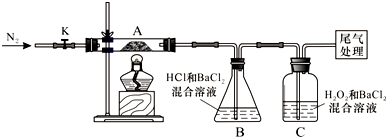
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
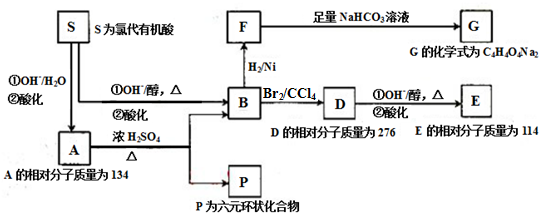
 .
.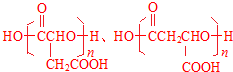 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
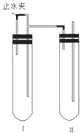 用下面两种方法可以制得白色的Fe(OH)2沉淀.
用下面两种方法可以制得白色的Fe(OH)2沉淀.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com