
【题目】在定温定容的密闭容器中合成![]() 。下列不能说明反应2SO2(g)+O2(g)
。下列不能说明反应2SO2(g)+O2(g)![]() 2SO3(g)达到化学平衡状态的是 ( )
2SO3(g)达到化学平衡状态的是 ( )
A. ![]()
B. 容器内的压强不再改变
C. SO3的生成速率与SO2 的生成速率相等
D. SO2 的转化率不再改变
【答案】A
【解析】
从化学平衡的本质和特征两方面,分析判断化学平衡的标志。
A项:化学平衡时,体系中各物质的物质的量或浓度不再随时间发生变化,但不一定相等,也不一定为化学计量数之比,![]() 项错误;
项错误;
B项:据pV=nRT,定温定容的密闭容器中,容器内的压强不再改变时,气体总物质的量不再变化,故反应已达化学平衡,B项正确;
C项:据化学方程式,任一时刻SO3的生成速率与SO2 的消耗速率相等。故当SO3的生成速率与SO2 的生成速率相等时,有SO2 的消耗速率等于SO2 的生成速率,容器中各物质的物质的量不再变化,是化学平衡,C项正确;
D项:当SO2 的转化率不再改变时,容器中SO2等物质的物质的量都保持不变,是化学平衡状态,D项正确。
本题选A。


科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。
(1)写出溴乙烷与NaOH水溶液共热的反应方程式:_______________,某同学取少量溴乙烷与NaOH水溶液反应后的混合溶液,向其中滴加AgNO3溶液,加热,产生少量沉淀。该同学由此得出溴乙烷与NaOH水溶液反应,生成了溴化钠,你认为是否合理,原因:____________________。
(2)写出溴乙烷与NaOH乙醇溶液共热的反应方程式:________,反应中生成的气体可以用如图所示装置检验,现象是______,水的作用是 ______。

(3)乙烯使溴水褪色的化学方程式: __________________________,X是比乙烯相对分子质量大14的乙烯的同系物,工业上用X生产塑料的化学方程式为:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气可用于制取漂白剂和自来水消毒。
(1)将氯气通入水中制得氯水,氯水可用于漂白,其中起漂白作用的物质是________(填写化学式)。
(2)“84”消毒液也可用于漂白,其工业制法是控制在常温条件下,将氯气通入NaOH溶液中,反应的离子方程式为______________________。
(3)同学们探究“84”消毒液在不同pH下使红纸褪色的情况,做了如下实验:
步骤1:将5 mL市售“84”消毒液稀释100倍,测得稀释后溶液的pH=12;
步骤2:将稀释后溶液各20 mL分别加入3个洁净的小烧杯中;
步骤3:用H2SO4溶液将3个烧杯内溶液的pH分别调至10、7和4。(溶液体积变化忽略不计)
步骤4:在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
烧杯 | 溶液的pH | 现象 |
a | 10 | 10 min后,红纸基本不褪色;4 h后红纸褪色 |
b | 7 | 10 min后,红纸颜色变浅;4 h后红纸褪色 |
c | 4 | 10 min后,红纸颜色变得更浅;4 h后红纸褪色 |
已知,溶液中Cl2、HClO和ClO-物质的量分数(α)随溶液pH变化的关系如下图所示:
![]()

①由实验现象可获得以下结论:溶液的pH在4~10范围内,pH越大,红纸褪色________。
②结合图像进行分析,b、c两烧杯中实验现象出现差异的原因是________。
(4)由于氯气会与自来水中的有机物发生反应生成对人体有害的物质,人们尝试研究并使用新的自来水消毒剂,如ClO2气体就是一种新型高效含氯消毒剂。
①一种制备ClO2的方法是用SO2通入硫酸酸化的NaClO3溶液中,反应的离子方程式为________。
②另一种制备ClO2的方法是用NaClO3与盐酸反应,同时有Cl2生成,产物中Cl2体积约占1/3,每生成0.5 mol ClO2,转移________mol e-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶于水时会发生电离产生自由移动的离子,电导率变化一定程度上可以反映溶液中自由移动的离子浓度变化。溶液中自由移动的离子浓度越大,电导率就越大。如图是向20mL0.01mol/LBa(OH)2溶液中滴入了2滴酚酞溶液,然后向Ba(OH)2溶液中匀速滴加0.2mol/LH2SO4溶液,获得电导率随时间变化的曲线图。
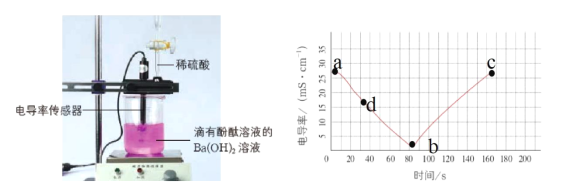
(1)0-80s观察到的实验现象是_____。
(2)写出该实验中的离子方程式_____。
(3)截至b点,加入0.2molL-1H2SO4溶液的体积为_____mL,解释b点的电导率不等于零和bc段电导率又增加的原因____。
(4)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是(_____)(多选题)
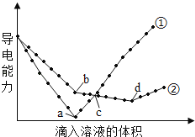
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.a、d两点对应的溶液均显中性
D.c点,两溶液中含有相同量的OH-
E.H+导电能力比Na+强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4均为温室气体,若得以综合利用,对温室气体整治具有重大意义。
(1)已知:
CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) △H=+247.3kJ·mol-1
2CO(g)+2H2(g) △H=+247.3kJ·mol-1
CH4(g)![]() C(s)+2H2(g) △H=+75.0kJ·mol-1
C(s)+2H2(g) △H=+75.0kJ·mol-1
反应2CO(g)![]() C(s)+CO2(g)在_______能自发进行。
C(s)+CO2(g)在_______能自发进行。
A、高温 B、低温 C、任意温度 D、任意温度都不能
(2)合成甲醇的主要反应是CO(g)+2H2(g)![]() CH3OH(g)。初始压强P1下,向体积为2L的恒容密闭容器中充入b mol CO和2b mol H2,平衡时CO的转化率与温度、压强的关系如图所示。请回答:
CH3OH(g)。初始压强P1下,向体积为2L的恒容密闭容器中充入b mol CO和2b mol H2,平衡时CO的转化率与温度、压强的关系如图所示。请回答:
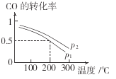
①下列判断正确的是______
A、放热反应 P1>P2 B、放热反应 P1<P2
C、吸热反应 P1>P2 D、吸热反应 P1<P2
②200℃时,该反应的平衡常数K=_______(用含b的代数式表示)。若上述反应经过tmin达到平衡,则该时间段内氢气的平均反应速率为_______。
(3)实验室可用Na2CO3 与盐酸混合制备少量CO2。在25℃时,取10.6g Na2CO3 与盐酸混合所得的一组体积为1L 的溶液,溶液中部分微粒与pH 的关系如图所示。则:
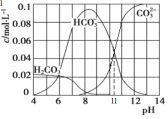
①根据图中数据,计算CO32-的水解常数K=____________________。
②pH = 6的溶液中:c(H2CO3)+ c(HCO3-)+ c(CO32-)_____(填>、<或=)0.1 mol·L-1
(4)以甲烷为燃料的酸性燃料电池负极反应式:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是工业上从海水中提取Mg的流程,下列说法正确的是
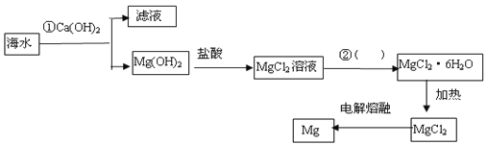
A.①反应的离子方程式是Mg2++2OH-=Mg(OH)2↓
B.②的实验操作不可以是蒸发浓缩、冷却结晶、过滤
C.工业上不会用电解熔融氧化镁制镁
D.MgCl26H2O可以直接加热得无水氯化镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性。
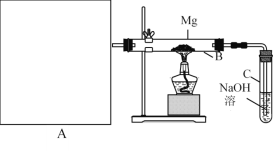
Ⅰ.用上图所示装置进行Mg和SO2的实验,其中A是制备SO2的发生装置。用80%的H2SO4溶液与Na2SO3固体制取SO2 。
(1) 写出装置B中发生的主要反应的化学方程式_____________________。装置C中NaOH溶液的作用是___。
(2)你认为该装置不足之处是什么?__________________________只要答出两点即可)。
Ⅱ.某研究性学习小组进行了“实验室制Si”的研究,它们以课本为基础,查阅资料得到以下可供参考的信息:①工业上在高温时用C还原SiO2可制得Si ②Mg在点燃的条件下即可与SiO2反应 ③金属硅化物与稀H2SO4反应生成硫酸盐与SiH4④Si和SiO2均不与稀H2SO4反应 ⑤SiH4在空气中自燃他们在研究报告中记载着“……选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥;最后称量……在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”。
(3) 该小组“实验室制Si”的化学方程式是______________________________________。
(4)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由N、P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,请回答下列问题:
(1)基态N的原子核外___种运动状态不同的电子,基态 P原子核外电子排布式为_____,P、S、Cl的第一电离能由大到小顺序为___。
(2)PCl3分子中的中心原子杂化轨道类型是__,该分子构型为____。
(3)PCl3 是一种无色的液体,遇水容易水解生成两种酸,则方程式__。
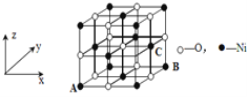
(4)已知MgO与NiO的晶体结构(如图)相同, 其中Mg2+和Ni2+的离子半径分别为66 pm和69pm。则熔点:MgO___NiO(填“>”、“<”或“=”),理由是__。
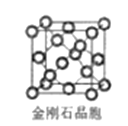
(5)金刚石晶胞含有__个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=___a,列式表示碳原子在晶胞中的空间占有率___(请用r和a表示不要求计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将标准状况下6.72L HCl溶于水配成100mL溶液,现用此盐酸与19.5g 锌粒反应制取氢气。试计算:(写出计算过程)
(1)此盐酸的物质的量浓度________________
(2)若要使锌完全反应,则所需盐酸的最小体积______________
(3)当锌粒完全反应时,制得标准状况下氢气的体积___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com