
【题目】电解质溶于水时会发生电离产生自由移动的离子,电导率变化一定程度上可以反映溶液中自由移动的离子浓度变化。溶液中自由移动的离子浓度越大,电导率就越大。如图是向20mL0.01mol/LBa(OH)2溶液中滴入了2滴酚酞溶液,然后向Ba(OH)2溶液中匀速滴加0.2mol/LH2SO4溶液,获得电导率随时间变化的曲线图。
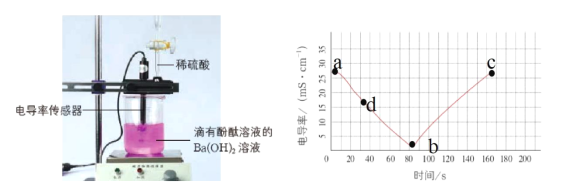
(1)0-80s观察到的实验现象是_____。
(2)写出该实验中的离子方程式_____。
(3)截至b点,加入0.2molL-1H2SO4溶液的体积为_____mL,解释b点的电导率不等于零和bc段电导率又增加的原因____。
(4)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是(_____)(多选题)
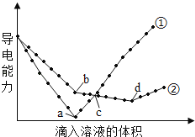
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.a、d两点对应的溶液均显中性
D.c点,两溶液中含有相同量的OH-
E.H+导电能力比Na+强
【答案】产生白色沉淀,溶液红色褪去,电导率减小 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O 1 b点:BaSO4在水中溶解度很小,溶液中SO42-和Ba2+浓度很小但不等于0。水存在微弱的电离,溶液中H+和OH-浓度很小但不等于0。溶液中有自由移动的离子,电导率不等于零。bc段:b点溶液中的Ba(OH)2被反应完,溶液中自由移动的离子浓度达到最小值,随着H2SO4溶液的不断滴加,溶液中H+和SO42-浓度变大,自由移动离子浓度变大,bc段电导率增加。 ABCE
【解析】
溶液的导电性由溶液中离子的浓度及离子电荷数决定,Ba(OH)2 是强电解质,开始滴定时溶液中离子浓度较大,溶液的电导率大,随反应的进行,溶液中钡离子生成硫酸钡沉淀,氢氧根离子变成水,恰好完全反应时,溶液中主要是水和极少量的硫酸钡,水是弱电解质,再继续加入硫酸,硫酸是强电解质,离子浓度增大,导电能力增强。
(1)0—80s,Ba(OH)2 是强电解质,开始滴定时溶液中离子浓度较大,溶液的电导率大,随反应的进行,溶液中钡离子生成硫酸钡沉淀,氢氧根离子变成水,恰好完全反应时,溶液中主要是水和极少量的硫酸钡。观察到的实验现象是产生白色沉淀,溶液红色褪去,电导率减小。
(2)该实验中硫酸与氢氧化钡反应生成硫酸钡沉淀和水,离子方程式2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O。
(3)截至b点,加入0.2molL-1H2SO4溶液的体积为V=20mL×0.01mol/L÷0.2molL-1=1mL;b点的电导率不等于零和bc段电导率又增加的原因: b点:BaSO4在水中溶解度很小,溶液中SO42-和Ba2+浓度很小但不等于0。水存在微弱的电离,溶液中H+和OH-浓度很小但不等于0。溶液中有自由移动的离子,电导率不等于零。bc段:b点溶液中的Ba(OH)2被反应完,溶液中自由移动的离子浓度达到最小值,随着H2SO4溶液的不断滴加,溶液中H+和SO42-浓度变大,自由移动离子浓度变大,bc段电导率增加。
(4)A.溶液中钡离子与SO42-生成硫酸钡沉淀,氢氧根离子与H+生成水,曲线①中a点溶液的导电能力接近0,①代表滴加H2SO4溶液的变化曲线,故A正确;
B.②是NaHSO4溶液与氢氧化钡反应,b点,氢氧化钡与硫酸氢钠以1:1物质的量之比反应生成硫酸钡、水和NaOH,溶液中有NaOH,溶液中大量存在的离子是Na+、OH-,故b正确;
C.a、d两点均将氢氧化钡全部反应,a点硫酸与氢氧化钡恰好反应生成硫酸钡和水,d点硫酸氢钠与氢氧化钡恰好反应生成硫酸钡、硫酸钠和水,a和d之后,硫酸均过量,a和d对应的溶液均显中性,故C正确;
D.c点,两溶液中导电能力相同,对曲线①硫酸过量,溶液呈酸性,对曲线②OH-未被完全中和,溶液呈碱性,OH-含量不相同,故D错误;
E.根据曲线①和②导电能力的变化幅度分析,H+导电能力比Na+强,故E正确;
故选ABCE。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是

A. X、Y两端都必须用铁作电极
B. 不可以用NaOH溶液作为电解液
C. 阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH-
D. X端为电解池的阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )。
A. 酚醛树脂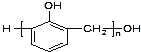 可由邻羟甲基苯酚发生加聚反应得到
可由邻羟甲基苯酚发生加聚反应得到
B. ![]() 与
与![]() 互为同系物
互为同系物
C. 合成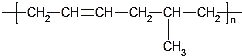 的单体是乙烯和 2-丁烯
的单体是乙烯和 2-丁烯
D. 天然橡胶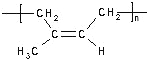 和杜仲胶
和杜仲胶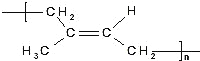 的单体是同一种物质
的单体是同一种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用氯酸钾和二氧化锰制取氧气的反应方程式为:2KClO3![]() 2KCl+3O2↑。
2KCl+3O2↑。
回答下列问题:
(1)该反应中被氧化的元素名称为 ,生成1mol O2时转移电子的数目是 。
(2)从反应后的固体混合物中分离出难溶于水的MnO2的具体实验操作名称: 。
(3)分离出的MnO2可用于实验室制取Cl2,化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,其离子方程式为 。
MnCl2+Cl2↑+2H2O,其离子方程式为 。
(4)若两个反应中转移的电子的物质的量相同,则生成的O2和Cl2在相同状况下的体积比为 .
(5)以上两个反应都用到MnO2,其作用分别是 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有A、B、C、D、E、F六种装置,如图所示。请回答下列问题(橡皮管、导管可自由选用)。
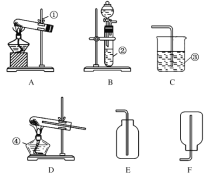

(1)实验室制取并收集氧气时应选择__________和__________相连接,制取并收集氢气时应选择__________和__________相连接。
(2)进行木炭还原氧化铜并检验生成气体的实验,应选择________和________相连接,检验气体时观察到的实验现象是__________________________________。
(3)实验室用无水醋酸钠固体和固体碱石灰加热制取甲烷气体。已知甲烷的密度比空气小,不溶于水。则制取甲烷气体可选用的装置为________,收集甲烷气体时可选用的装置为________。
(4)如图是某学生设计的一种有洗气、贮气等用途的装置。欲除去O2中混有的水蒸气,瓶中可盛________。当用排水法收集氢气时,瓶内先装满水,气体从________(填“a”或“b”,下同)导管口通入。若要用水将瓶中氢气排出,水应从________导管口进入。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第二周期是非金属元素最多的周期,回答下列问题。
(1)在硼酸分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则同层分子间的主要作用力是___________________
(2)第一电离能介于B、N之间的第二周期元素有_________________种。
(3)HNO3的酸性比HNO2强,试从结构的角度解释其原因_____________________
(4)碳与硅同主族,晶体硅的结构同金刚石相同,推测硅的熔点比金刚石的________(高、低)。设硅原子的半径为r,则硅晶体晶胞的棱长为_______________(用带r的算式表示),晶胞的空间利用率为______________(保留两位有效数字)
(5)石墨烯与金属R可以形成一种插层化合物。其中R层平行于石墨层,晶胞如图甲所示,其垂直于石墨层方向的投影如图乙所示。则该插层化合物的化学式为_____;

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在定温定容的密闭容器中合成![]() 。下列不能说明反应2SO2(g)+O2(g)
。下列不能说明反应2SO2(g)+O2(g)![]() 2SO3(g)达到化学平衡状态的是 ( )
2SO3(g)达到化学平衡状态的是 ( )
A. ![]()
B. 容器内的压强不再改变
C. SO3的生成速率与SO2 的生成速率相等
D. SO2 的转化率不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,已知PdI2在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
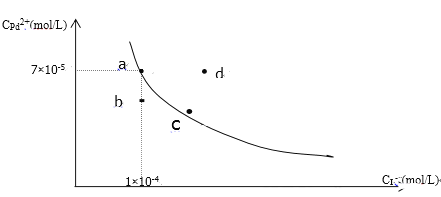
A. 在t℃时PdI2的Ksp=7.0×10-9
B. 图中a点是饱和溶液,b、d两点对应的溶液都是不饱和溶液
C. 向a点的溶液中加入少量NaI固体,溶液由a点向c点方向移动
D. 要使d点移动到b点可以降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是( )
A. H2SO4+2NaOH==Na2SO4+2H2O
B. 2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
C. NH3+HCl==NH4Cl
D. CuO+H2![]() Cu+H2O
Cu+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com