
【题目】今有A、B、C、D、E、F六种装置,如图所示。请回答下列问题(橡皮管、导管可自由选用)。
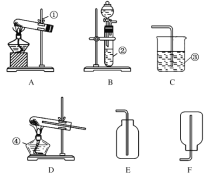

(1)实验室制取并收集氧气时应选择__________和__________相连接,制取并收集氢气时应选择__________和__________相连接。
(2)进行木炭还原氧化铜并检验生成气体的实验,应选择________和________相连接,检验气体时观察到的实验现象是__________________________________。
(3)实验室用无水醋酸钠固体和固体碱石灰加热制取甲烷气体。已知甲烷的密度比空气小,不溶于水。则制取甲烷气体可选用的装置为________,收集甲烷气体时可选用的装置为________。
(4)如图是某学生设计的一种有洗气、贮气等用途的装置。欲除去O2中混有的水蒸气,瓶中可盛________。当用排水法收集氢气时,瓶内先装满水,气体从________(填“a”或“b”,下同)导管口通入。若要用水将瓶中氢气排出,水应从________导管口进入。
【答案】A E B F A C 澄清石灰水变浑浊 A F 浓硫酸 b a
【解析】
(1)从图可以看出,实验室制取氧气时,只能采用固、固加热型装置(B装置中无固体,不满足H2O2分解制O2的条件),所以应选择A装置,答案为A。
收集氧气时,因为没有排水集气的装置,只能选择向上排空气的装置,所以应选择和E相连接。答案为E
制取氢气时,应选择固、液不加热装置,即选择B装置。答案为B
收集氢气,可采用向下排空气的装置,即选择F装置。答案为F
(2)进行木炭还原氧化铜,应选择A装置。答案为A
检验生成气体的实验,即检验CO2气体,所以应使用澄清石灰水,与C相连接。答案为C
检验气体时观察到的实验现象是澄清石灰水变浑浊。
答案为:澄清石灰水变浑浊
(3)实验室用无水醋酸钠固体和固体碱石灰加热制取甲烷气体。已知甲烷的密度比空气小,不溶于水。则制取甲烷气体采用固、固加热型装置,可选用的装置为A。答案为A
收集甲烷气体时采用向下排空气法,可选用的装置为F。答案为:F
(4)如图是某学生设计的一种有洗气、贮气等用途的装置。欲除去O2中混有的水蒸气,瓶中可盛浓硫酸。答案为:浓硫酸
当用排水法收集氢气时,瓶内先装满水,气体从b管导入。答案为:b
若要用水将瓶中氢气排出,水应从a导管口进入。答案为:a


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】下列实验中正确的是
A. 提取溶解在水中的少量碘:加入酒精振荡、静置分层后,取出有机层再分离
B. 下图所示装置都适宜于HCl气体尾气吸收
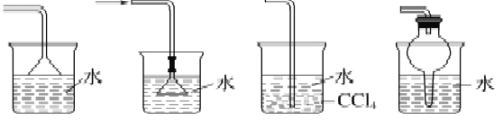
C. 酸碱滴定实验中,用待测溶液润洗锥形瓶以减小实验误差;在用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体。
D. 除去酸性MgCl2溶液中少量的FeCl3:加入足量的Mg(OH)2 并过滤;除去NH4Cl溶液中的FeCl3,可向溶液中加入氨水调节pH .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.用如图所示的装置进行电解,在通电一段时间后,铁电极的质量增加。
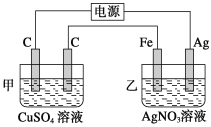
(1)写出甲中发生反应的化学方程式:____________________________。
(2)写出乙中两极发生的电极反应式。
阳极:_______________;阴极:_____________________。
Ⅱ.在一定温度下,将2mol A和2mol B两种气体相混合于容积为2 L的某密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g),2min末反应达到平衡状态,生成了0.6mol D,并测得C的浓度为0.3mol/L,请填写下列空白:
xC(g)+2D(g),2min末反应达到平衡状态,生成了0.6mol D,并测得C的浓度为0.3mol/L,请填写下列空白:
(1)x值等于__________。
(2)A的转化率为__________。
(3)生成D的反应速率为________________。
(4)达平衡后保持容器内气体压强不变,向其中加入He(He不参加反应),则平衡______移动(填“正向”“逆向 “或”“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气可用于制取漂白剂和自来水消毒。
(1)将氯气通入水中制得氯水,氯水可用于漂白,其中起漂白作用的物质是________(填写化学式)。
(2)“84”消毒液也可用于漂白,其工业制法是控制在常温条件下,将氯气通入NaOH溶液中,反应的离子方程式为______________________。
(3)同学们探究“84”消毒液在不同pH下使红纸褪色的情况,做了如下实验:
步骤1:将5 mL市售“84”消毒液稀释100倍,测得稀释后溶液的pH=12;
步骤2:将稀释后溶液各20 mL分别加入3个洁净的小烧杯中;
步骤3:用H2SO4溶液将3个烧杯内溶液的pH分别调至10、7和4。(溶液体积变化忽略不计)
步骤4:在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
烧杯 | 溶液的pH | 现象 |
a | 10 | 10 min后,红纸基本不褪色;4 h后红纸褪色 |
b | 7 | 10 min后,红纸颜色变浅;4 h后红纸褪色 |
c | 4 | 10 min后,红纸颜色变得更浅;4 h后红纸褪色 |
已知,溶液中Cl2、HClO和ClO-物质的量分数(α)随溶液pH变化的关系如下图所示:
![]()

①由实验现象可获得以下结论:溶液的pH在4~10范围内,pH越大,红纸褪色________。
②结合图像进行分析,b、c两烧杯中实验现象出现差异的原因是________。
(4)由于氯气会与自来水中的有机物发生反应生成对人体有害的物质,人们尝试研究并使用新的自来水消毒剂,如ClO2气体就是一种新型高效含氯消毒剂。
①一种制备ClO2的方法是用SO2通入硫酸酸化的NaClO3溶液中,反应的离子方程式为________。
②另一种制备ClO2的方法是用NaClO3与盐酸反应,同时有Cl2生成,产物中Cl2体积约占1/3,每生成0.5 mol ClO2,转移________mol e-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月9日中国科学院正式向社会发布113号、115号、117号和118号元素的中文名称。已知117号元素有多种原子,如![]() 、
、![]() 等。下列说法正确的是
等。下列说法正确的是
A. ![]() 和
和![]() 的化学性质完全不同
的化学性质完全不同
B. 元素Ts的相对原子质量为![]()
C. 基态![]() 原子核外电子共占据7个能级
原子核外电子共占据7个能级
D. Ts位于周期表的第七周期ⅦA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶于水时会发生电离产生自由移动的离子,电导率变化一定程度上可以反映溶液中自由移动的离子浓度变化。溶液中自由移动的离子浓度越大,电导率就越大。如图是向20mL0.01mol/LBa(OH)2溶液中滴入了2滴酚酞溶液,然后向Ba(OH)2溶液中匀速滴加0.2mol/LH2SO4溶液,获得电导率随时间变化的曲线图。
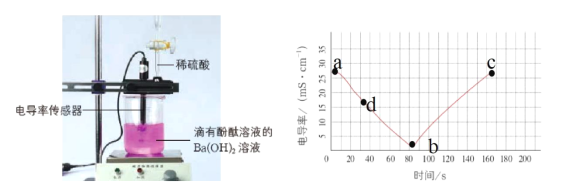
(1)0-80s观察到的实验现象是_____。
(2)写出该实验中的离子方程式_____。
(3)截至b点,加入0.2molL-1H2SO4溶液的体积为_____mL,解释b点的电导率不等于零和bc段电导率又增加的原因____。
(4)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是(_____)(多选题)
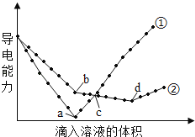
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.a、d两点对应的溶液均显中性
D.c点,两溶液中含有相同量的OH-
E.H+导电能力比Na+强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4均为温室气体,若得以综合利用,对温室气体整治具有重大意义。
(1)已知:
CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) △H=+247.3kJ·mol-1
2CO(g)+2H2(g) △H=+247.3kJ·mol-1
CH4(g)![]() C(s)+2H2(g) △H=+75.0kJ·mol-1
C(s)+2H2(g) △H=+75.0kJ·mol-1
反应2CO(g)![]() C(s)+CO2(g)在_______能自发进行。
C(s)+CO2(g)在_______能自发进行。
A、高温 B、低温 C、任意温度 D、任意温度都不能
(2)合成甲醇的主要反应是CO(g)+2H2(g)![]() CH3OH(g)。初始压强P1下,向体积为2L的恒容密闭容器中充入b mol CO和2b mol H2,平衡时CO的转化率与温度、压强的关系如图所示。请回答:
CH3OH(g)。初始压强P1下,向体积为2L的恒容密闭容器中充入b mol CO和2b mol H2,平衡时CO的转化率与温度、压强的关系如图所示。请回答:
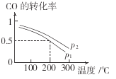
①下列判断正确的是______
A、放热反应 P1>P2 B、放热反应 P1<P2
C、吸热反应 P1>P2 D、吸热反应 P1<P2
②200℃时,该反应的平衡常数K=_______(用含b的代数式表示)。若上述反应经过tmin达到平衡,则该时间段内氢气的平均反应速率为_______。
(3)实验室可用Na2CO3 与盐酸混合制备少量CO2。在25℃时,取10.6g Na2CO3 与盐酸混合所得的一组体积为1L 的溶液,溶液中部分微粒与pH 的关系如图所示。则:
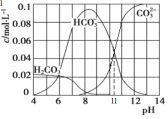
①根据图中数据,计算CO32-的水解常数K=____________________。
②pH = 6的溶液中:c(H2CO3)+ c(HCO3-)+ c(CO32-)_____(填>、<或=)0.1 mol·L-1
(4)以甲烷为燃料的酸性燃料电池负极反应式:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性。
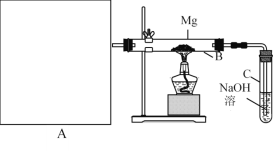
Ⅰ.用上图所示装置进行Mg和SO2的实验,其中A是制备SO2的发生装置。用80%的H2SO4溶液与Na2SO3固体制取SO2 。
(1) 写出装置B中发生的主要反应的化学方程式_____________________。装置C中NaOH溶液的作用是___。
(2)你认为该装置不足之处是什么?__________________________只要答出两点即可)。
Ⅱ.某研究性学习小组进行了“实验室制Si”的研究,它们以课本为基础,查阅资料得到以下可供参考的信息:①工业上在高温时用C还原SiO2可制得Si ②Mg在点燃的条件下即可与SiO2反应 ③金属硅化物与稀H2SO4反应生成硫酸盐与SiH4④Si和SiO2均不与稀H2SO4反应 ⑤SiH4在空气中自燃他们在研究报告中记载着“……选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥;最后称量……在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”。
(3) 该小组“实验室制Si”的化学方程式是______________________________________。
(4)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究金属钠与水或盐酸的反应记录如下。
实验序号 | 实验内容 | 实验现象 |
I | 0.23g钠与20mL蒸馏水 | 钠浮在水面上,熔成小球四处游动,发出嘶嘶响声,20s后钠块消失 |
II | 0.23g纳与20ml | 钠浮在水面上,熔成小球四处游动,发出嘶嘶响声,13s后钠块消失 |
(1)由实验现象可推断:金属钠与水成盐酸的反应,反应的共同特征是__________(写出两点)。
(2)研究实验I
①实验前水中![]() ______________。
______________。
②实验结束后所得溶液显碱性,原因可能是____________(填序号)。
a.生成的氢氧化钠属于碱
b.氢氧化钠在水中能电离出![]()
c.氢氧化钠抑制了水的电离,导致由水电离产生的![]()
d.钠与![]() 反应,促进水的电离,导致
反应,促进水的电离,导致![]()
(3)研究实验II
①实验前溶液pH=_____________
②实验结束后,溶液中离子浓度由大到小的顺序是_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com