
【题目】下列说法正确的是( )。
A. 酚醛树脂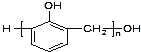 可由邻羟甲基苯酚发生加聚反应得到
可由邻羟甲基苯酚发生加聚反应得到
B. ![]() 与
与![]() 互为同系物
互为同系物
C. 合成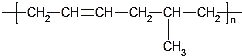 的单体是乙烯和 2-丁烯
的单体是乙烯和 2-丁烯
D. 天然橡胶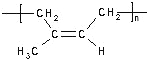 和杜仲胶
和杜仲胶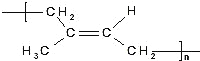 的单体是同一种物质
的单体是同一种物质
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.C燃烧的热化学方程式为:C(s)+1/2O2(g)=CO(g) △H = 110.5kJ·mol-1
B.由H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1可知,若将含1molCH3COOH的稀溶液与含1molNaOH的稀溶液混合,放出的热量小于57.3kJ
C.碳酸氢钠水解的离子方程式:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D.500℃、30MPa下,将0.5molN2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放出热量19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。
(1)写出溴乙烷与NaOH水溶液共热的反应方程式:_______________,某同学取少量溴乙烷与NaOH水溶液反应后的混合溶液,向其中滴加AgNO3溶液,加热,产生少量沉淀。该同学由此得出溴乙烷与NaOH水溶液反应,生成了溴化钠,你认为是否合理,原因:____________________。
(2)写出溴乙烷与NaOH乙醇溶液共热的反应方程式:________,反应中生成的气体可以用如图所示装置检验,现象是______,水的作用是 ______。

(3)乙烯使溴水褪色的化学方程式: __________________________,X是比乙烯相对分子质量大14的乙烯的同系物,工业上用X生产塑料的化学方程式为:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,则下列说法不正确的是
A. 标准状况下,18gH2O所含电子数为10NA
B. 22.4L CO2与17 g NH3所含分子数相等
C. 0.9g铝与足量的盐酸反应,失去的电子数为0.1NA
D. 常温下,1L 0.1mol/L NaCl溶液中含Na+ 数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.用如图所示的装置进行电解,在通电一段时间后,铁电极的质量增加。
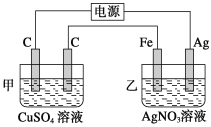
(1)写出甲中发生反应的化学方程式:____________________________。
(2)写出乙中两极发生的电极反应式。
阳极:_______________;阴极:_____________________。
Ⅱ.在一定温度下,将2mol A和2mol B两种气体相混合于容积为2 L的某密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g),2min末反应达到平衡状态,生成了0.6mol D,并测得C的浓度为0.3mol/L,请填写下列空白:
xC(g)+2D(g),2min末反应达到平衡状态,生成了0.6mol D,并测得C的浓度为0.3mol/L,请填写下列空白:
(1)x值等于__________。
(2)A的转化率为__________。
(3)生成D的反应速率为________________。
(4)达平衡后保持容器内气体压强不变,向其中加入He(He不参加反应),则平衡______移动(填“正向”“逆向 “或”“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氯乙烯是制作装修材料的最常用原料,失火时聚氯乙烯在不同的温度下,发生一系列复杂的化学变化,产生大量有害气体,其过程大体如下:

下列说法不正确的是
A. 聚氯乙烯的单体可由乙烯与HCl加成而得
B. 上述反应中①属于消去反应,④属于(脱氢)氧化反应
C. 火灾中由聚氯乙烯产生的有害气体中含HCl、CO、C6H6等
D. 在火灾现场,可以用湿毛巾捂住口鼻,并弯下腰尽快远离现场
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气可用于制取漂白剂和自来水消毒。
(1)将氯气通入水中制得氯水,氯水可用于漂白,其中起漂白作用的物质是________(填写化学式)。
(2)“84”消毒液也可用于漂白,其工业制法是控制在常温条件下,将氯气通入NaOH溶液中,反应的离子方程式为______________________。
(3)同学们探究“84”消毒液在不同pH下使红纸褪色的情况,做了如下实验:
步骤1:将5 mL市售“84”消毒液稀释100倍,测得稀释后溶液的pH=12;
步骤2:将稀释后溶液各20 mL分别加入3个洁净的小烧杯中;
步骤3:用H2SO4溶液将3个烧杯内溶液的pH分别调至10、7和4。(溶液体积变化忽略不计)
步骤4:在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
烧杯 | 溶液的pH | 现象 |
a | 10 | 10 min后,红纸基本不褪色;4 h后红纸褪色 |
b | 7 | 10 min后,红纸颜色变浅;4 h后红纸褪色 |
c | 4 | 10 min后,红纸颜色变得更浅;4 h后红纸褪色 |
已知,溶液中Cl2、HClO和ClO-物质的量分数(α)随溶液pH变化的关系如下图所示:
![]()

①由实验现象可获得以下结论:溶液的pH在4~10范围内,pH越大,红纸褪色________。
②结合图像进行分析,b、c两烧杯中实验现象出现差异的原因是________。
(4)由于氯气会与自来水中的有机物发生反应生成对人体有害的物质,人们尝试研究并使用新的自来水消毒剂,如ClO2气体就是一种新型高效含氯消毒剂。
①一种制备ClO2的方法是用SO2通入硫酸酸化的NaClO3溶液中,反应的离子方程式为________。
②另一种制备ClO2的方法是用NaClO3与盐酸反应,同时有Cl2生成,产物中Cl2体积约占1/3,每生成0.5 mol ClO2,转移________mol e-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶于水时会发生电离产生自由移动的离子,电导率变化一定程度上可以反映溶液中自由移动的离子浓度变化。溶液中自由移动的离子浓度越大,电导率就越大。如图是向20mL0.01mol/LBa(OH)2溶液中滴入了2滴酚酞溶液,然后向Ba(OH)2溶液中匀速滴加0.2mol/LH2SO4溶液,获得电导率随时间变化的曲线图。
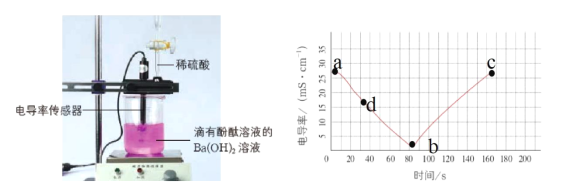
(1)0-80s观察到的实验现象是_____。
(2)写出该实验中的离子方程式_____。
(3)截至b点,加入0.2molL-1H2SO4溶液的体积为_____mL,解释b点的电导率不等于零和bc段电导率又增加的原因____。
(4)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是(_____)(多选题)
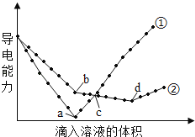
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.a、d两点对应的溶液均显中性
D.c点,两溶液中含有相同量的OH-
E.H+导电能力比Na+强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由N、P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,请回答下列问题:
(1)基态N的原子核外___种运动状态不同的电子,基态 P原子核外电子排布式为_____,P、S、Cl的第一电离能由大到小顺序为___。
(2)PCl3分子中的中心原子杂化轨道类型是__,该分子构型为____。
(3)PCl3 是一种无色的液体,遇水容易水解生成两种酸,则方程式__。
(4)已知MgO与NiO的晶体结构(如图)相同, 其中Mg2+和Ni2+的离子半径分别为66 pm和69pm。则熔点:MgO___NiO(填“>”、“<”或“=”),理由是__。
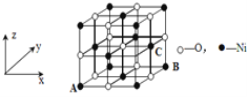
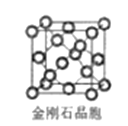
(5)金刚石晶胞含有__个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=___a,列式表示碳原子在晶胞中的空间占有率___(请用r和a表示不要求计算结果)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com