
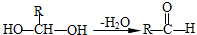
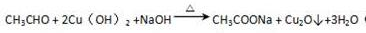

 .
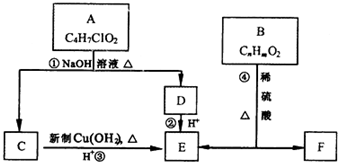
. 分析 A能和NaOH的水溶液发生反应生成C和D,A的不饱和度=$\frac{4×2+2-7-1}{2}$=1,说明A中含有一个双键,A水解后生成的B能发生银镜反应,则B中含有醛基,D酸化后生成E,C被催化氧化生成E,说明C、D结构简式中碳原子个数相等,则A结构简式为CH3COOCHClCH3,C结构简式为CH3CHO,D为CH3COONa,E为CH3COOH,B的摩尔质量为162g/mol,完全燃烧的产物中n(CO2):n(H2O)=2:1,说明B中C、O原子个数之比为1:1,B能发生水解反应生成乙酸,设B分子式为CxHxO2,x=$\frac{162-16×2}{13}$=10,则B分子数为C10H10O2,B不饱和度=$\frac{10×2+2-10}{2}$=6,F是生产高分子光阻剂的主要原料,F能发生加聚反应说明含有碳碳不饱和键,含有苯环且苯环上一氯取代物只有两种,遇氯化铁溶液显紫色,说明含有酚羟基,且两个取代基位于对位,则F结构简式为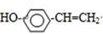 ,B结构简式为
,B结构简式为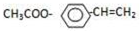 ,结合题目分析解答.
,结合题目分析解答.
解答 解:A能和NaOH的水溶液发生反应生成C和D,A的不饱和度=$\frac{4×2+2-7-1}{2}$=1,说明A中含有一个双键,A水解后生成的B能发生银镜反应,则B中含有醛基,D酸化后生成E,C被催化氧化生成E,说明C、D结构简式中碳原子个数相等,则A结构简式为CH3COOCHClCH3,C结构简式为CH3CHO,D为CH3COONa,E为CH3COOH,B的摩尔质量为162g/mol,完全燃烧的产物中n(CO2):n(H2O)=2:1,说明B中C、O原子个数之比为1:1,B能发生水解反应生成乙酸,设B分子式为CxHxO2,x=$\frac{162-16×2}{13}$=10,则B分子数为C10H10O2,B不饱和度=$\frac{10×2+2-10}{2}$=6,F是生产高分子光阻剂的主要原料,F能发生加聚反应说明含有碳碳不饱和键,含有苯环且苯环上一氯取代物只有两种,遇氯化铁溶液显紫色,说明含有酚羟基,且两个取代基位于对位,则F结构简式为 ,B结构简式为
,B结构简式为 ,
,
(1)通过以上分析知,A结构简式为CH3COOCHClCH3,C发生氧化反应生成E,故答案为:CH3COOCHClCH3;氧化反应;
(2)C为乙醛,C与新制Cu(OH)2 的化学方程式为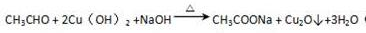 ,
,
故答案为: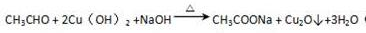 ;
;
(3)通过以上分析知,B分子式为C10H10O2,故答案为:C10H10O2;
(4)F为 ,F与浓溴水反应方程式为
,F与浓溴水反应方程式为 ,
,
故答案为: ;
;
(5)B结构简式为 ,B与氢氧化钠反应方程式为
,B与氢氧化钠反应方程式为 ,
,
故答案为: .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断及信息获取、应用能力,明确常见有机物官能团及其性质关系、常见反应类型是解本题关键,注意结合题给信息进行推断,易错点是B中C、H原子个数计算,题目难度不大.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 该溶液中H+、Fe2+、SO42-、Cl-可以大量共存 | |
| B. | 向该溶液中通入SO2气体不会发生反应 | |
| C. | 向该溶液中加入过量氨水发生反应的离子方程式Al3++4NH3•H2O═AlO2-+4NH4++2H2O: | |
| D. | 向该溶液中滴入Na2CO3溶液发生反应的离子方程式:2Al3++3CO32-+3 H2O═2Al(OH)3↓+3CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的和操作 | 影响结果 | 原因分析 |
| A | 将2g I2加入到98mLCCl4中溶解混匀后,配制质量分数为2% I2的CCl4溶液 | 偏小 | CCl4的密度大于1g•mL-1 |
| B | 用10mL的量筒测量酯化反应得到乙酸乙酯的体积,俯视液面读出数据为6.0mL | 偏小 | 平视读取应大于6.0mL |
| C | 配制2mol•L-1NaCl溶液,定容时加入的水超过了刻度线,立即用滴管吸出多余的水,再摇匀 | 无影响 | 吸出了多余的水 |
| D | 用尖嘴有气泡的碱式滴定管盛标准NaOH溶液滴定20.00mL某待测HCl溶液的浓度 | 偏大 | 流出碱液的量 变大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度(℃) | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
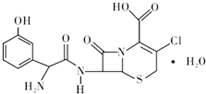 头孢克洛是人工合成的第二代口服头孢菌抗生素,主要用于上、下呼吸道感染、中耳炎、皮肤、尿道感染等症状,其结构如图所示,下列关于头孢克洛的说法错误的是( )
头孢克洛是人工合成的第二代口服头孢菌抗生素,主要用于上、下呼吸道感染、中耳炎、皮肤、尿道感染等症状,其结构如图所示,下列关于头孢克洛的说法错误的是( )| A. | 其分子式可以表示为C15H16ClN3O6S | |
| B. | 该物质具有两性 | |
| C. | 1 mol该化合物与NaOH溶液作用时消耗NaOH的物质的量最多为 4 mol | |
| D. | 该物质遇FeCl3溶液显紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(O2)=0.01mol/(L•s) | B. | v(NO)=0.08mol/(L•s) | ||
| C. | v(H2O)=0.003mol/(L•s) | D. | v(NH3)=0.001mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y、Z、W单核离子均能破坏水的电离平衡 | |
| B. | W元素氧化物对应水化物的酸性一定强于Z | |
| C. | 含X、Y、Z三种元素组成的化合物不止2种 | |
| D. | 因为X的氢化物分子间有氢键,所以X的氢化物较Z的氢化物稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com