
| 选项 | 实验目的和操作 | 影响结果 | 原因分析 |
| A | 将2g I2加入到98mLCCl4中溶解混匀后,配制质量分数为2% I2的CCl4溶液 | 偏小 | CCl4的密度大于1g•mL-1 |
| B | 用10mL的量筒测量酯化反应得到乙酸乙酯的体积,俯视液面读出数据为6.0mL | 偏小 | 平视读取应大于6.0mL |
| C | 配制2mol•L-1NaCl溶液,定容时加入的水超过了刻度线,立即用滴管吸出多余的水,再摇匀 | 无影响 | 吸出了多余的水 |
| D | 用尖嘴有气泡的碱式滴定管盛标准NaOH溶液滴定20.00mL某待测HCl溶液的浓度 | 偏大 | 流出碱液的量 变大 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.CCl4的密度大于1g/mL;
B.腐蚀读数偏大;
C.吸出的液体中含有溶质,导致溶质的物质的量n偏小;
D.碱式滴定管尖嘴部分的气泡没全部赶跑,导致标准液体积读数偏大.
解答 解:A.CCl4的密度大于1g/mL,所以98mL CCl4的质量大于98g,所以将2g I2加入到98mL CCl4中溶解混匀后,即得质量分数小于2%,故A正确;
B.腐蚀读数偏大,平视读数小于6.0mL,故B错误;
C.吸出的液体中含有溶质,导致溶质的物质的量n偏小,溶液的浓度偏低,故C错误;
D.碱式滴定管尖嘴部分的气泡没全部赶跑,导致标准液体积读数偏大,测定结果偏高,故D错误.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及溶液配制的误差分析,熟悉配制的原理和正确的操作步骤是解题关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 过滤操作时,应用玻璃棒作引流 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下18g铝放入足量浓硫酸中转移电子数2NA | |
| B. | 0.1mol/L的稀硫酸中含有H+个数为0.2NA | |
| C. | 27g Al分别与足量的稀硫酸及氢氧化钠溶液反应失去的电子数都是3NA | |
| D. | 标准状况下,22.4LCCl4所含分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| B. | 在0.1 mol•L-1NaHS溶液中:c(H+)=c(OH-)+c(S2-)+c(HS-) | |
| C. | 将0.1 mol•L-1Na2CO3溶液和0.2 mol•L-1NaHCO3溶液等体积混合:3c(Na+)=4c(CO32-)+4c(HCO3-) | |
| D. | 向0.1 mol•L-1NaHSO4溶液中滴加氨水至溶液恰好呈中性:c(Na+)=c(NH4+)=c(SO42-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8g苯中碳碳双键的数目为0.3NA | |
| B. | 由1mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-的个数为NA | |
| C. | 常温常压,11.2L NO和O2混合气体的原子数为NA | |
| D. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数为0.46NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 产生白色沉淀反应的离子方程式为:2Cu2++4I-=2CuI↓+I2 | |
| B. | 通入SO2后溶液逐渐变成无色,体现了SO2的漂白性 | |
| C. | 上述实验条件下,物质的氧化性强弱顺序为:Cu2+>I2>SO2 | |
| D. | 滴加KI溶液时,每生成1mol CuI转移1mol e- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
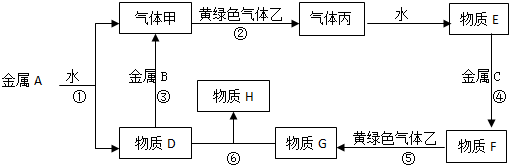
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
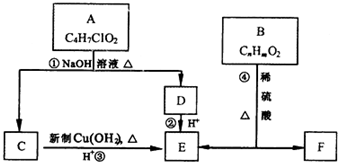
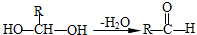
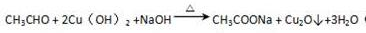

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com