
分析 2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O中,Mn元素的化合价降低,Cl元素的化合价升高,则HCl为还原剂,对应氧化产物为Cl2,据此计算氧化产物与还原产物的物质的量之比,根据化合价的升降确定电子转移的情况.
解答 解:2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O中,Mn元素的化合价降低,氧化剂为KMnO4,对应还原产物为MnCl2,Cl元素的化合价升高,则HCl为还原剂,对应氧化产物为Cl2,氧化产物与还原产物的物质的量之比为5:2,若产生的气体1mol,则反应过程中转移电子10mol,若产生的气体在标准状况下体积为2.24L即0.1mol,则反应过程中转移电子为0.2 NA,被氧化的盐酸和参加反应的盐酸物质的量之比是10:16=5:8,若产生的气体在标准状况下体积为2.24L即0.1mol,消耗盐酸是0.32mol,被氧化的盐酸的物质的量是0.2mol,电子转移如下: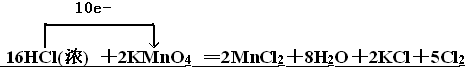 .
.
故答案为:KMnO4;5:2;0.2;0.2mol;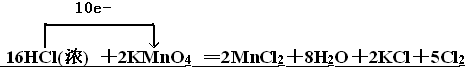 .
.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应中基本概念,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
 25℃时,在20ml 0.1mol•L-1NaOH溶液中逐滴加入0.2mol•L-1醋酸溶液,滴定曲线如图所示,有关粒子浓度的关系中,不正确的是( )
25℃时,在20ml 0.1mol•L-1NaOH溶液中逐滴加入0.2mol•L-1醋酸溶液,滴定曲线如图所示,有关粒子浓度的关系中,不正确的是( )| A. | 在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | B. | 在B点:c(Na+)﹦c(CH3COO-)>c(OH-)﹦c(H+) | ||
| C. | 在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | D. | 在C点:c(CH3COO-)+c(CH3COOH)﹦2 c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 浓度 | 28.42g•L-1 | 1.6g/L |
| 排放标准 | pH=6~9 | 0.5mg/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com