
【题目】四种短周期元素X、Y、Z和W在周期表中的位置如图所示,原子序数之和为48。下列说法不正确的是

A. 原子半径(r)大小比较r(X)>r(Y)
B. X和W可形成化合物XW3
C. W的非金属性比Z的强,所以W氢化物的沸点比Z的高
D. Z的最低价单核阴离子的失电子能力比Y的强
【答案】C
【解析】
X、Y、Z、W四种短周期元素,由位置可知,X、Y在第二周期,Z、W在第三周期,设Y的原子序数为y,则X的原子序数为y-1,Z的原子序数为y+8,W的原子序数为y+9,X、Y、Z和W的原子序数之和为48,则y-1+y+y+8+y+9=48,解得y=8,所以Y为O,Z为S,W为Cl,X为N,则
A、在同一周期内,自左向右原子半径逐渐减小,原子半径(r)大小比较r(X)>r(Y),故A正确;
B、X为N元素,W为Cl元素,可以形成共价化合物NCl3,故B正确;
C、熔沸点为物质的物理性质,氢化物的沸点与分子间作用力有关,与非金属性无关,故C错误;
D、非金属性Z<Y,故Z的最低价单核阴离子的失电子能力强于Y,故D正确。
综上所述,答案选C。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeCO3F)为原料制备CeO2的一种工艺流程如下:
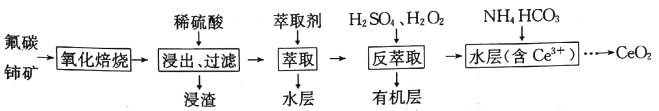 已知:i.Ce4+能与Fˉ结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
已知:i.Ce4+能与Fˉ结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
ⅱ.在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能
ⅲ.常温下,Ce2(CO3)3饱和溶液浓度为1.0×10-6mol·L-1。
回答下列问题:
(1)“氧化焙烧”过程中可以加快反应速率和提高原料利用率的方法是__________、__________ (写出2种即可)。
(2)写出“氧化焙烧”产物CeO2与稀H2SO4反应的离子方程式:__________。
(3)“萃取”时存在反应:Ce4++n(HA)2![]() Ce(H2n-4A2n)+4H+。D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=
Ce(H2n-4A2n)+4H+。D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=![]() )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)增大而减小的原因是_____________。
)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)增大而减小的原因是_____________。
(4)浸渣经处理可得Ce(BF4)3,加入KCl溶液发生如下反应:
Ce(BF4)3(s)+ 3K+(aq) ![]() 3KBF4(s)+ Ce3+(aq)。
3KBF4(s)+ Ce3+(aq)。
若一定温度时,Ce(BF4)3、KBF4的Ksp分别为a、b,则该反应的平衡常数K=__________(用a、b表示)。
(5)“反萃取”中加H2O2的主要反应离子方程式为__________。在“反萃取”后所得水层中加入1.0mol·L-1的NH4HCO3溶液,产生Ce2(CO3)3沉淀,当Ce3+沉淀完全时[c(Ce3+)=1×10-5mol·L-1],溶液中c(CO32-)约为__________。
(6)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2![]() CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:___________。
CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的原子序数依次增大。其中A元素原子的核外p电子数比s电子数少1。C是电负性最大的元素。D原子次外层电子数是最外层电子数2倍,E是第Ⅷ族中原子序数最小的元素。
(1)写出基态C原子的电子排布式_________________。
(2)A、B两种元素的第一电离能由大到小的顺序为______________(用元素符号表示),原因是___________________。
(3)已知DC4常温下为气体,则该物质的晶体类型是_________,组成微粒的中心原子的轨道杂化类型为____________,空间构型是___________。
(4)Cu2+容易与AH3形成配离子[Cu(AH3)4]2+,但AC3不易与Cu2+形成配离子,其原因是______________________。
(5)A、B两元素分别与D形成的共价键中,极性较强的是__________。A、B两元素间能形成多种二元化合物,其中与A3—互为等电子体的物质的化学式为__________。
(6)已知E单质的晶胞如图所示,则晶体中E原子的配位数为__________,一个E的晶胞质量为___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时有关弱酸的电离平衡常数如下表:
弱电解质化学式 | CH3COOH | HCN | H2CO3 | NH3.H2O |
电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.4×10-7 K2=4.7×10-11 | 1.8×10-5 |
下列推断正确的是( )
A. 25℃时,同浓度的下列溶液 pH 关系为:pH(NaHCO3)>pH(NaCN)>pH(CH3COONa)
B. 若25℃时某溶液中c(CO32-)=c(HCO3-),则此溶液中 c(H+)=4.7×10-11 mol·L-1
C. 若25℃时某溶液中c(CO32-)=c(HCO3-),往该溶液中滴入少量盐酸后, c(CO32-)>c(HCO3-)
D. 25℃时等浓度的NaCN和NH4Cl溶液,前者的阴离子浓度之和大于后者的阳离子浓度之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按下列要求填空:
(1)已知99 ℃时,水的离子积常数Kw=1.0×10-12,该温度下测得0.1 mol·L-1 Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为_________________________。
②体积相等、pH=1的盐酸与H2A溶液分别与足量Zn反应,产生的氢气___(填编号)。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
③将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为__________________________________。
(2)常温下,HNO2 的电离常数Ka=7.1×10-4mol·L-1,NH3·H2O的电离常数Kb=1.7×10-5mol·L-1。0.1mol·L-1 NH4NO2 溶液中离子浓度由大到小的顺序是__________________
(3)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图所示。

① 乙烯电子式为_________
②b电极的名称是_________
③请写出电解时生成乙烯的电极反应式____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将8.34 g FeSO4·7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如图所示。则下列说法不正确的是

A. 在100℃时,M的化学式为FeSO4·4H2O
B. FeSO4·7H2O晶体中有4种不同结合力的水分子
C. FeSO4·H2O存在的最高温度为373℃
D. 380℃的P加热至650℃时的化学方程式为:2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)Fe2O3是主氧化剂,与Na发生置换反应生成的还原产物为________(填化学式)。
(2)KClO4是助氧化剂,其中含有化学键的类型为________________________。
(3)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为
________________________________________________________________。
(4)NaN3是气体发生剂,受热分解产生N2和Na。取56 g上述产气药剂,分解产生的气体通过碱石灰后的体积为16.8 L(标准状况),该产气药剂中NaN3的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种石墨烯锂硫电池(2Li+S8=Li2S8)工作原理示意如图。下列有关该电池说法正确的是

A. B电极发生还原反应
B. A电极上发生的一个电极反应为:2Li++S8+2e-=Li2S8
C. 每生成1mol Li2S8转移0.25mol电子
D. 电子从B电极经过外电路流向A电极,再经过电解质流回B电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.72 g由金属钠、氧化钠和过氧化钠组成的混合物与足量水反应,在标准状况下得到672 mL混合气体。将该混合气体用电火花点燃,恰好完全反应,则原混合物中钠、氧化钠、过氧化钠的物质的量之比是( )
A. 3∶2∶1 B. 4∶2∶1 C. 2∶1∶1 D. 1∶1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com