
【题目】把pH=3的H2SO4溶液和pH=10的NaOH溶液混合,两者恰好中和,则酸和碱的体积比应是( )
A. 10∶1 B. 1∶10
C. 1∶100 D. 1∶2
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】某电动汽车配载一种可充放电的锂离子电池。放电时电池的总反应为:Li1-xCoO2+LixC6=LiCoO2+ C6(x<1)。下列关于该电池的说法不正确的是
A. 放电时,Li+在电解质中由负极向正极迁移
B. 充电时,若转移1mole-,石墨C6电极将增重7xg
C. 放电时,负极的电极反应式为LixC6-xe-= xLi++ C6
D. 充电时,阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种新型的固体氧化物型燃料电池,装置如图所示,在两极上分别通入甲烷和空气,电解质是掺杂了 Y2O3的ZrO3固体。在高温熔融状态下能传导O2-。下列说法正确的是
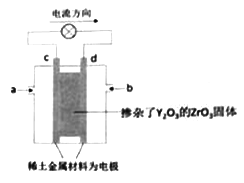
A. a处通入的甲烷
B. 工作时,在熔融电解质中,O2-离子移向d电极
C. c电极为正极,发生氧化反应
D. d电极的电极反应式:O2+4e-=2O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生反应2SO3(g)![]() 2SO2(g)+O2(g),将1molSO3气体通入1L容积恒定的密闭容器中,维持容器内温度不变,5min末测得SO3的物质的量为0.4mol。则下列说法正确的是( )
2SO2(g)+O2(g),将1molSO3气体通入1L容积恒定的密闭容器中,维持容器内温度不变,5min末测得SO3的物质的量为0.4mol。则下列说法正确的是( )
A. 0~5min,O2的生成速率v(O2)=0.06mol·L-1·min-1
B. 若起始时充入3molSO3,起始时SO3分解速率不变
C. 若某时刻消耗了0.5molSO3同时生成了0.25molO2,则表明该反应达到了平衡状态
D. 达到平衡时,SO2和SO3的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 11gC3H8与CO2的混合气体中所含碳原子数可能为0.5NA
B. 标准状况下,4.48L甲烷和乙烯的混合气体完全燃烧,产物中所含O-H键数目为0.4NA
C. 4.6gNa与100mL1mol·L-1的盐酸溶液反应,转移电子数目为0.1NA
D. 常温下,1LpH=2的硫酸溶液中由水电离出的H+的数目为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200℃和a℃时,反应X(g) ![]() 4Y(g)+Z(g)中X的浓度随时间变化的关系如图所示。
4Y(g)+Z(g)中X的浓度随时间变化的关系如图所示。
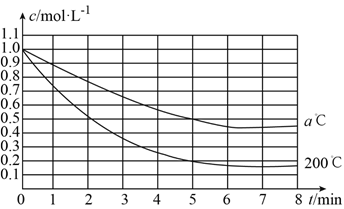
(1)200℃时5min内用Y表示的平均反应速率为__________。
(2)200℃、8min时,Z的浓度为__________。
(3)200℃时,在__________时,反应达到平衡状态。
(4)200℃、7min时,v正__________v逆(填“>”、“<”或“=”)。
(5)从图中可以看出,a__________200(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为______________。
②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是______(填字母序号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

①滴定醋酸的曲线是_________(填“I”或“Ⅱ”)。
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是_______。
③V1和V2的关系:V1___V2(填“>”、“=”或“<”)。
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_______。
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN>AgI。
操作步骤 | 现象 |
步骤1:向2mL0.005mol/LAgNO3溶液中加入2mL0.005mol/L KSCN溶液,静置。 | 出现白色沉淀 |
步骤2:取1mL上层清液于试管中,滴加1滴2mol/LFe(NO3)3溶液。 | 溶液变红色。 |
步骤3:向步骤2的溶液中,继续加入5滴3mol/LAgNO3溶液。 | 现象a,溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3mol/LKI溶液。 | 出现黄色沉淀。 |
①写出步骤2中溶液变红色的离子方程式_____________。
②步骤3中现象a是_____________。
③用化学平衡原理解释步骤4的实验现象___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com