
已知五种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.104 | 0.111 | 0.066 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
下列叙述正确的是
A.L与Q形成的化合物属于共价化合物 B.L、M的单质与稀盐酸反应速率:M>L
C.T、Q的氢化物常温常压下均为无色气体 D.M的最高价氧化物的水化物具有两性
【知识点】元素周期表,元素周期律
【答案解析】D 解析:L和R的化合价都为+2价,应为周期表第ⅡA族元素,根据半径关系可知R为Be,L为Mg,Q和T的化合价都有-2价,应为周期表第ⅥA族元素,Q的最高价为+6价,应为S元素,T无正价,应为O元素,M的化合价为+3价,应为周期表第ⅢA族元素,根据半径大于S,为Al元素,A、Mg与S形成MgS,属于离子化合物,故A错误;B、金属性Mg>Al,所以与稀盐酸反应速率:Mg>Al,故B错误;C、三氧化硫常温下为液态,故C错误;D、M的最高价氧化物的水化物是氢氧化铝,氢氧化铝是两性氢氧化物,故D正确;
故答案选D
【思路点拨】本题根据元素相应化合价及半径的比较首先推断元素,在正确推断出元素后根据元素周期律的相关应用即可判断出各选项,综合性较强,考察学生相应的推断能力。


科目:高中化学 来源: 题型:
下列解释事实的方程式不正确的是( )
A.测0.1 mol/L氨水的pH为11:
NH3·H2O NH
NH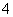 +OH-
+OH-
B.将Na块放入水中,产生气体:
2Na+2H2O===2NaOH+H2↑
C.用CuCl2溶液做导电实验,灯泡发光:
CuCl2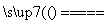 Cu2++2Cl-
Cu2++2Cl-
D.Al片溶于NaOH溶液中,产生气体:
2Al+2OH-+2H2O===2AlO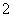 +3H2↑
+3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
H2SO4溶解A12O3的离子方程式是
KMnO4 - 氧化Fe2+的离子方程式补充完整:

(3)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的: 。
(4)己知:一定条件下,MnO4 - 可与Mn2+反应生成MnO2。
① 向 Ⅲ 的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是 。
② Ⅳ 中加入MnSO4的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:
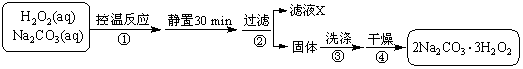 已知:主反应 2Na2CO3 (aq) + 3H2O2 (aq)
已知:主反应 2Na2CO3 (aq) + 3H2O2 (aq)  2Na2CO3·3H2O2 (s) ΔH < 0
2Na2CO3·3H2O2 (s) ΔH < 0
副反应 2H2O2 = 2H2O + O2↑
滴定反应 6KMnO4 + 5(2Na2CO3·3H2O2) +19H2SO4 =
3K2SO4 + 6MnSO4 +10Na2SO4 + 10CO2 ↑ + 15O2↑ + 34H2O
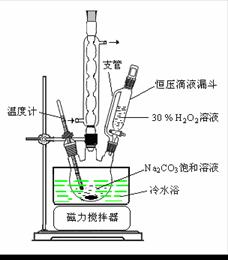 50 °C时 2Na2CO3·3H2O2 (s) 开始分解
50 °C时 2Na2CO3·3H2O2 (s) 开始分解
请回答下列问题:
(1)图中支管的作用是 。
(2)步骤①的关键是控制温度,其措施有 、
和 。
(3)在滤液X中加入适量NaCl固体或无水乙醇,
均可析出过碳酸钠,原因是 。
(4)步骤③中选用无水乙醇洗涤产品的目的
是 。
(5)下列物质中,会引起过碳酸钠分解的有 。
A.Fe2O3 B.CuO
C.Na2SiO3 D.MgSO4
(6)准确称取0.2000 g 过碳酸钠于250 mL 锥形瓶中,加50 mL 蒸馏水溶解,再加50 mL 2.0 mol·L-1 H2SO4,用2.000×10-2 mol·L-1 KMnO4 标准溶液滴定至终点时消耗30.00 mL,则产品中H2O2的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定地方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL。计算该样品中氯的物质的量,并求出FeClx中x的值: (列出计算过程)
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl) = 1∶2.1,则该样品中FeCl3的物质的量分数为 。在实验室中,FeCl2可用铁粉和 反应制备,FeCl3可用铁粉和 反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为 。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为 ;与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为 ,该电池总反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验是化学研究的基础。对下列实验的现象描述不正确的是

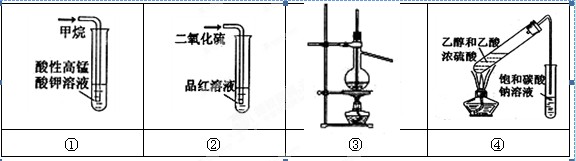
A、实验①溶液不褪色
B、实验②溶液褪色
C、装置③用于石油的分馏
D、实验④饱和碳酸钠溶液上方出现油状液体
查看答案和解析>>
科目:高中化学 来源: 题型:
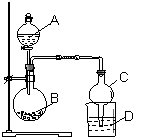
如右图所示装置进行实验,将液体A逐滴加入到固体B中, 下列叙述中错误的是( )
A.实验中仪器C可起到防止倒吸的作用
B. 若A为醋酸,B为贝壳(粉状),D中盛C6H5ONa
溶液,则D中溶液变浑浊
C. 若A为浓氨水,B为生石灰,D中盛AgNO3溶液,
则D中无现象
D. 若A为食盐水,B为电石,D中盛KMnO4酸性溶液,则D
中溶液紫红色褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com