
肼N2H4空气燃料电池是一种环保型碱性燃料电池,电解液是20%~30%的KOH溶液。电池总反应为:N2H4+O2=N2+2H2O。下列关于该电池工作时的说法正确的是
A.负极的电极反应式是:N2H4+4OH--4e-=4H2O+N2↑
B.正极的电极反应式是:O2+4H++4e-=2H2O
C.溶液中阴离子向正极移动
D.溶液中阴离子物质的量基本不变
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:阅读理解
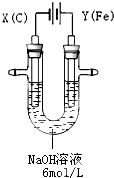 高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.
高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.| 充电 | 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
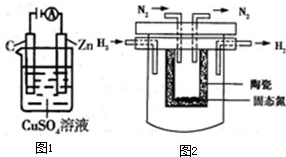
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:北京市101中学2011-2012学年高二下学期期中考试化学试题 题型:058
高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如下图所示.
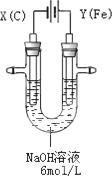
Ⅰ.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
(1)电解过程中,X极是________极,电极反应是________.
(2)电解过程中,Y极放电的有________.
(3)生成高铁酸根(FeO42-)的电极反应是________.
Ⅱ.若用不同种电池作为上述实验的电源,请分析电池反应.
(1)铅蓄电池总的化学方程式为:
Pb+PbO2+2H2SO4![]() 2H2O+2PbSO4,则它在充电时的阳极反应为________.
2H2O+2PbSO4,则它在充电时的阳极反应为________.
(2)镍镉碱性充电电池在放电时,其两极的电极反应如下:
正极:2NiOOH+2H2O+2e-=2Ni(OH)2+2OH-
负极:Cd+2OH——2e-=Cd(OH)2
则它在放电时的总反应的化学方程式为________.
(3)肼(N2H4)是一种可燃性液体,可用作火箭燃料.已知在25℃、101 kPa时,32.0 g N2H4在氧气中完全燃烧生成氮气和液态水,放出624 kJ的热量,则N2H4完全燃烧的热化学方程式是________;
肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,放电时负极的电极反应是________.
(4)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐,电池总反应方程式为:C3H8+5O2=3CO2+4H2O.写出该电池正极的电极反应:________.
(5)当制备相同物质的量的高铁酸钾时,理论上,上述四种电池中分别消耗的Pb、Cd、肼、丙烷的物质的量之比是________.
查看答案和解析>>
科目:高中化学 来源:2014届贵州省遵义市高三五校联考理综化学试卷(解析版) 题型:填空题
(1)、①用肼(N2H4)为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水。
已知:N2(g)+2O2(g)=N2O4(g) ΔH=+10.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543kJ·mol-1
写出气态肼和N2O4反应的热化学方程式: 。
②已知四氧化二氮在大气中或在较高温度下很难稳定存在,其很容易转化为二氧化氮。试推断由二氧化氮制取四氧化二氮的反应条件(或措施): 。
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。
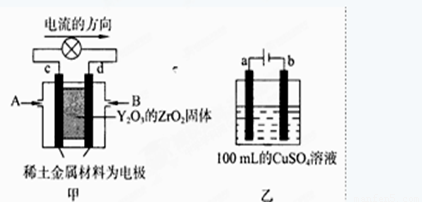
图甲所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e →2O2-)
①c电极为 ,d电极上的电极反应式为 。
②图乙是电解100mL 0.5mol·L-1 CuSO4溶液,a电极上的电极反应式为 。若a电极产生56mL(标准状况)气体,则所得溶液的pH= (不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入 (选填字母序号)
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com