
已知M2O7x﹣+3S2﹣+14H+=2M3++3S↓+7H2O,则M2O7x﹣中的M的化合价为( )
A.+2 B.+3 C.+4 D.+6
科目:高中化学 来源:2016-2017学年山西省高一上期中化学试卷(解析版) 题型:选择题
下列判断哪些是正确的
①氢氧化钠是电解质
②强电解质溶液的导电性一定比弱电解质溶液导电性强
③氯化银难溶于水,所以氯化银是非电解质
④蔗糖易溶于水,所以是电解质
⑤氯气溶于水后导电,所以Cl2是电解质
A.① B.①③ C.①②⑤ D.①②③⑤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高一阶段考一化学卷(解析版) 题型:填空题
焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈.发生的 反应体系中共有六种物质:NH4Cl、
反应体系中共有六种物质:NH4Cl、 FeCl3、N2、Fe2O3、Fe和X。
FeCl3、N2、Fe2O3、Fe和X。
(1)根据题意,可判断出X是_________(写化学式)。
(2)写出并配平该反应的化学方程式:_________;
(3)发生还原反应的物质是_________,反应中2mol的氧化剂能_________(填“失去”或“得到”)_________mol电子.
(4)反应中被氧化产生了5.6L(标准状况)的气体时,被还原的物质的质量为_________.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高一阶段考一化学卷(解析版) 题型:选择题
已知反应①2BrO3﹣+Cl2=Br2+2ClO3﹣;②5Cl2+I2+6H2O=2HIO3+10HCl;③ClO3﹣+5Cl﹣+6H+=3Cl2+3H2O,下列有关氧化(还原)能力强弱顺序正确的是( )
A.还原性:C l﹣>I2>Br2>Cl2 B.还原性:Cl﹣>I2>Cl2>Br2
l﹣>I2>Br2>Cl2 B.还原性:Cl﹣>I2>Cl2>Br2
C.氧化性:BrO3﹣>ClO3﹣>Cl2>IO3﹣ D.氧化性:Cl2>BrO3﹣>C1O3﹣>IO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| w(CaO)% NaOH浓度& 浸出率% 碱用量c/mol•L-1 | 0.1 | 1.3 | 1.3 | 2.7 |
| 30 | 30 | 40 | 40 | |
| 1.1 | 99.1 | 90.1 | 93.3 | 83.2 |
| 1.3 | 99.4 | 92.7 | 93.0 | 82.1 |
| 1.5 | 99.5 | 93.4 | 96.5 | 83.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
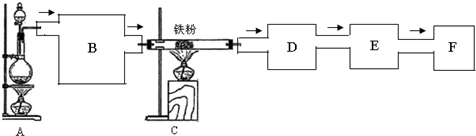

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com