
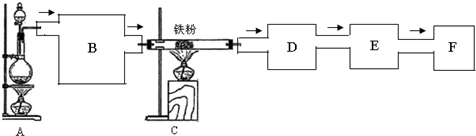

分析 (1)浓盐酸和二氧化锰反应生成氯化锰、氯气和水,根据离子方程式的书写方法书写;
(2)根据分液漏斗的使用方法:打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,缓慢滴加液体;
(3)可以用生成的氯气排除装置中的空气,根据黄绿色气体充满装置C时,再开始加热C;
(4)二氧化锰与浓盐酸反应制得氯气中含氯化氢和水蒸气,故采用洗气法除去其中杂质,可以用浓硫酸吸水,用饱和食盐水吸收氯化氢;
(5)根据无水三氯化铁在100℃左右时升华来解答;根据Fe3+在溶液中遇到KSCN溶液作用生成红色物质来检验;
(6)无水三氯化铁易潮解,需要防止F装置中的水气进入;
(7)氯气有毒,实验过程中需要尾气处理.
解答 解:(1)浓盐酸和二氧化锰在加热条件下能发生反应生成氯化锰、氯气、水,方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2 ↑+2H2O,离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++
Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)使用分液漏斗滴加浓盐酸的操作是:打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,缓慢滴加浓盐酸;
故答案为:打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,缓慢滴加浓盐酸;
(3)A处是制取氯气,C处是氯气和铁反应,所以先点A处酒精灯,使制取的Cl2排尽装置内的空气,一旦黄绿色气体充满装置C时,再开始加热C;
故答案为:黄绿色气体充满装置C时,再开始加热C;
(4)二氧化锰与浓盐酸反应制得氯气中含氯化氢和水蒸气,先用饱和食盐水除去氯气中的氯化氢,再用浓硫酸干燥.装置图如下: ;
;
故答案为: ;
;
(5)无水三氯化铁在100℃左右时升华,所以装置D的作用是收集固体FeCl3,为了检验上述产物,可取少量产物溶于适量蒸馏水中,滴加KSCN溶液,显红色;
故答案为:收集固体FeCl3;取少量产物溶于适量蒸馏水中,滴加KSCN溶液,显红色;
(6)无水三氯化铁易潮解,为了防止F装置中的水气进入,装置E中盛放的试剂是浓H2SO4,
故答案为:浓H2SO4;防止F装置中的水气进入D中;
(7)氯气有毒,实验过程中需要用NaOH溶液吸收多余Cl2,防止污染空气;
故答案为:NaOH溶液;吸收多余Cl2,防止污染空气.
点评 本题以氯化铁的制备为环境,考查了氯气的制备和性质的检验,解题关键理在于明确实验原理和目的及各装置的作用,题目难度中等.


科目:高中化学 来源:2016-2017学年山西省高二上10月月考化学试卷(解析版) 题型:实验题
如图为硬脂酸甘油酯(结构简式为 )在碱性条件下水解的装置图。进行皂化反应时的步骤如下:
)在碱性条件下水解的装置图。进行皂化反应时的步骤如下:

(1)在圆底烧瓶中装入7~8 g硬脂酸甘油酯,然后加入2~3 g氢氧化钠,5 mL水和10 mL酒精。加入酒精的作用是____________。
g氢氧化钠,5 mL水和10 mL酒精。加入酒精的作用是____________。
(2)隔着石棉网给反应混合物加热约10 min,皂化反应基本完成,所得到的混合物为_____________(填“悬浊液”、“乳浊液”、“溶液”或“胶体”)。
( 3)图中长玻璃导管的作用为_________________________。
3)图中长玻璃导管的作用为_________________________。
(4)写出该反应的化学方程式_________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一上期中化学试卷(解析版) 题型:选择题
某同学对胶体知识认识正确的是
A.溶液是电中性的,胶体是带电的
B.向饱和氯化铁溶液中滴加过量氨水,可制取氢氧化铁胶体
C.葡萄糖注射液能产生丁达尔效应,属于胶体
D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者没有
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高一阶段考一化学卷(解析版) 题型:选择题
已知M2O7x﹣+3S2﹣+14H+=2M3++3S↓+7H2O,则M2O7x﹣中的M的化合价为( )
A.+2 B.+3 C.+4 D.+6
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ③④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | TiCl4溶于大量水加热制备TiO2 | |
| B. | 热的纯碱溶液用于清洗油污 | |
| C. | 次氯酸钠常用作消毒剂 | |
| D. | FeCl3饱和溶液滴入沸水中制Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cu2+ K+ Na+ SO42- | B. | K+ Na+ Cl-HCO3- | ||
| C. | Cl- NO3- Mg2+ NH4+ | D. | NO3- Na+ Cl-K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com