



 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、2mol SO2气体与足量的O2在一定条件下反应,转移的电子数为4×6.02×1023 |
B、铵根离子的结构式: |
| C、谷氨酸的熔点高达205℃,主要是因为晶体中羧基与氨基之间形成较强的氢键 |
| D、常温下,100mL pH=1的硫酸溶液中含有的H+离子数为0.01×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将一定质量的镁和铝的混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示,则下列说法不正确的是
将一定质量的镁和铝的混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示,则下列说法不正确的是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸.
硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
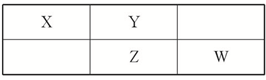 四种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
四种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素R、Q、M、T在元素周期表中的相对位置如下表,已知R原子最外层电子数与次外层电子数之比为2:1.
短周期元素R、Q、M、T在元素周期表中的相对位置如下表,已知R原子最外层电子数与次外层电子数之比为2:1.| R | Q | ||
| M | T |
| +x |
| +x |
| 化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH-Na2CO3-BaCl2 |
| B、NaOH-BaCl2-Na2CO3 |
| C、BaCl2-NaOH-Na2CO3 |
| D、Na2CO3-BaCl2-NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com