
【题目】汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol,则下列判断正确的是( )
A.生成42.0 L N2(标准状况) B.转移电子的物质的量为1.25 mol
C.有0.250 mol KNO3被氧化 D.被氧化的N原子的物质的量为3.75 mol
【答案】BD
【解析】
试题分析:10NaN3+2KN03→K20+5Na20+16N2↑中,N元素由+5价降低为0,反应中共转移10电子,若氧化产物比还原产物多1.75mol,由反应可知,生成16molN2时氧化产物比还原产物多14mol,则该反应生成氮气为![]() =2mol。A、生成标况下氮气的体积为2mol×22.4L/mol=44.8L,故A错误;B、转移电子的物质的量为0.25mol×(5-0)=1.25mol,故B正确;C、由反应可知,KN03被还原,被还原的硝酸钾的物质的量为2mol×
=2mol。A、生成标况下氮气的体积为2mol×22.4L/mol=44.8L,故A错误;B、转移电子的物质的量为0.25mol×(5-0)=1.25mol,故B正确;C、由反应可知,KN03被还原,被还原的硝酸钾的物质的量为2mol×![]() =0.25mol,故C错误;D、转移10mol电子被氧化的N原子为30mol,则转移1.25mol电子被氧化的N原子的物质的量为
=0.25mol,故C错误;D、转移10mol电子被氧化的N原子为30mol,则转移1.25mol电子被氧化的N原子的物质的量为![]() =3.75mol,故D正确;故选BD。
=3.75mol,故D正确;故选BD。


 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
A.950mL,11.2g
B.500mL,117g
C.1000mL,117.0g
D.任意规格,111.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定质量的钠与铁的金属混合物,放入足量的水中充分反应,过滤。向滤渣中加入足量的1.5 mol·L-1盐酸,使滤渣完全溶解,测得生成的气体在标准状况下的体积是1.12L。另向滤液中加入酚酞试剂,溶液变红,再向其中逐滴加入1.5mol·L-1盐酸至红色恰好褪去,此时消耗盐酸的体积为120.0mL。试回答下列问题:
(1)写出金属钠与水反应的化学方程式 。
写出金属铁与稀盐酸反应的离子方程式 。
(2)试计算该金属混合物的总质量。(没有计算过程不得分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两种有机物不属于同分异构体的是
A. 葡萄糖与果糖 B. CH3CH2COOH和CH3COOCH3
C. 正丁烷和异丁烷 D. 淀粉和纤维素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关性质的比较,错误的是( )
A. 酸性:H2SO4 > H2CO3 B. 沸点:CBr4>CCl4
C. 碱性:Al(OH)3 > NaOH D. 热稳定性:HF > HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】14C 常用于测定年代,关于其说法正确的是( )
A. 比 12C 多两个质子 B. 与 12C 化学性质相似
C. 与 12C 互为同素异形体 D. 质子数与中子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】DME(二甲醚、CH3OCH3)是一种重要的清洁能源,可作为柴油的理想替代燃料和民用燃料,被誉为“二十一世纪的新能源”。另外,二甲醚还被广泛用作致冷剂、气雾剂以及有机化工中间体。
(1)工业上一步法制二甲醚的生产流程如下:
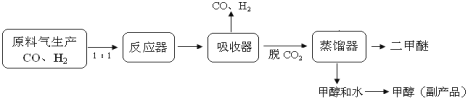
在一定的温度(230-2800C)、压强(2-10MPa)和催化剂作用下,反应器中进行下列一些反应:
CO(g)+2H2(g)![]() CH3OH(g)△H=—90.7kJ·mol—1
CH3OH(g)△H=—90.7kJ·mol—1
2CH3OH(g)![]() CH3OCH3(g)+H2O(g)△H=—23.5kJ·mol—1
CH3OCH3(g)+H2O(g)△H=—23.5kJ·mol—1
CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=—41.2kJ·mol—1
CO2(g)+H2(g)△H=—41.2kJ·mol—1
反应器中总反应式可表示为:3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g),则该反应的△H = 。
CH3OCH3(g)+CO2(g),则该反应的△H = 。
(2)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H>0。判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是 。
CH3OCH3(g)+3H2O(g) △H>0。判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是 。
A.容器中密度不变 B.容器内压强保持不变
C.v(CO2)︰v(H2)=1︰3 D.单位时间内消耗2molCO2,同时消耗1mol二甲醚
(3)二甲醚也可以通过CH3OH分子间脱水制得2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H = —23.5kJ·mol—1 ,在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
CH3OCH3(g)+H2O(g) △H = —23.5kJ·mol—1 ,在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。

T1℃时,若改变起始浓度,某时刻各组分浓度依次为:C(CH3OH)=0.4mol/L 、C(H2O)=0.6 mol/L、C(CH3OCH3)=
1.2 mol/L,此时正、逆反应速率的大小:V正_______V逆(填“>”、“<”、或“=”)。
(4)如图为二甲醚燃料电池的工作原理示意图。请回答下列问题:
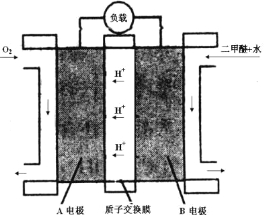
①A电极是 极。
②B电极上发生的电极反应式是 。
③若燃料电池中通入二甲醚(沸点为-24.9 ℃)的速率为1.12L/min(标准状况),以该燃料电池作为电源电解2 mol·L—1CuSO4溶液500mL,则通电30秒钟后理论上在阴极可析出金属铜 g(假设整个过程中,能量利用率为75%)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com