
某氯化铁样品含有FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:
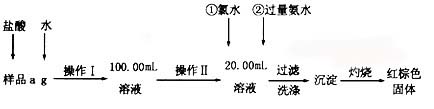
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、
(填仪器名称).
(2)加入过量氨水生成沉淀的离子方程式为 ;
(3)若不用氯水,可用下列试剂中的 代替(填序号)。
A.H2O2 B.碘水 C.NaClO
(4)步骤⑤中检验沉淀是否洗净的方法是 。
(5)若坩埚质量为W1g,坩埚及灼烧后的固体总质量为W2g,样品中铁元素的质量分数为
(请把结果约到最简)。
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
已知有机化合物 A、B、C、D、E存在下图所示转化关系,且C能跟NaHCO3发生反应,C和D的相对分子质量相等,E为无支链的化合物。
请回答下列问题:

(1)已知E的相对分子质量为102,其中碳、氢两种元素的质量分数分别为58.8%、9.8%,其余为氧,则E的分子式为 。
(2)B在一定条件下可以发生缩聚反应生成某高分子化合物,此高分子化合物的结构简式为 。
(3)D也可以由溴代烃F在NaOH溶液中加热来制取,写出此反应的化学方程式 。
(4)A的结构简式是 。
(5)B有多种同分异构体,请写出一种同时符合下列四个条件的结构简式: 。
a.能够发生水解 b.能发生银镜反应
c.能够与FeCl3溶液显紫色 d.苯环上的一氯代物只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子在溶液中能大量共存,加入(NH4)2Fe(SO4)2•6H2O晶体后,仍能大量共存的是( )
A.Na+、H+、Cl-、NO3- B.Na+、Mg2+、Cl-、SO42-
C.K+、Ba2+、OH-、I- D.Cu2+、CO32-、Br-、ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组指定物质的同分异构体数目相等的是
A.乙烷的二氯代物和丙烷的一氯代物 B.丙烷的一氯代物和戊烷
C.苯的二氯代物和苯的一硝基代物 D.C3H6和C5H12
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家研制出多种新型杀虫剂代替DDT,化合物M是其中的一种。下列关于M的说法错误的是
A.M的分子式为C15H22O3
B.与FeCl3溶液发生反应后溶液不显紫色
C.M可以发生银镜反应
| |
D.1molM最多与1molH2完全加成
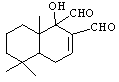 化合物M
化合物M
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语正确的是( )
|
| A. | 氮分子的电子式: | B. | 氮原子电子排布式:1s22s22p5 |
|
| C. | 硝基苯的结构简式为 | D. | 表示甲烷分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:
氯气是一种重要的工业原料.工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气.下列说法错误的是( )
|
| A. | 若管道漏气遇氨就会产生白烟 | B. | 该反应利用了Cl2的强氧化性 |
|
| C. | 该反应属于复分解反应 | D. | 生成1mol N2有6mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列递变规律正确的是( )
A.P、S、C1最高正价依次降低 B.钠、镁、铝的还原性依次减弱
C.HC1、HBr、HI的稳定性依次增强 D.HC1O、H2SO4、H3PO4的酸性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
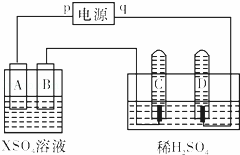
如图,p、q为直流电源的两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D极上均产生气泡.试回答:
(1)p为 正 极,A极发生了 氧化 反应.
(2)C为 阳 极,试管里收集到的气体是 氧气 .
(3)C极的电极反应式是 4OH﹣﹣4e﹣=O2↑+2H2O .
(4)在电解过程中,测得的C、D两极上产生的气体的实验数据如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极生成气体体积 (cm3) | 6 | 12 | 20 | 29 | 39 | 49 | 59 | 69 | 79 | 89 |
| 阳极生成气体体积 (cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
仔细分析以上实验数据,造成阴、阳两极气体体积比变化的可能原因是 开始时阴、阳两极气体体积比为3:1,10分钟时约为2:1,说明开始时氧气溶解于溶液中 .
(5)当反应进行一段时间后,A、B电极所在的电解池中溶液的pH 不变 (填“增大”、“减小”或“不变”).
(6)当电路中通过0.004mol电子时,B电极上沉积金属X为0.128g,则此金属的摩尔质量为 64g/mol .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com