
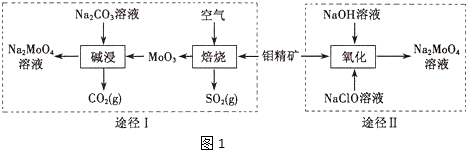
分析 利用钼精矿(主要成分是MoS2)制备钼酸钠有两种途径:途径Ⅰ是先在空气中灼烧生成MnO3,同时得到对环境有污染的气体SO2,然后再用纯碱溶液溶解MnO3,即可得到钼酸钠溶液,最后结晶得到钼酸钠晶体;途径Ⅱ是直接用NaClO溶液在碱性条件下氧化钼精矿得到钼酸钠溶液,结晶后得到钼酸钠晶体;
(1)合金是指由一种金属与其它金属或非金属熔合而成的具有金属特性的物质,合金的硬度大,熔点低,陶瓷属于无机非金属材料,二氧化锆为化合物无丁达尔效应;
(2)①途径I碱浸时MoO3和纯碱溶液反应生成钼酸钠,同时得到CO2气体,反应方程式为MoO3+Na2CO3=Na2MoO4+CO2↑;
②途径Ⅱ用NaClO在碱性条件下氧化MoO3,得到钼酸钠和NaCl和水,据此可写出离子反应方程式;
(3)四钼酸铵[(NH4)2MoO4]和氢氧化钠反应可生成NH3,途径Ⅰ中生成的气体有CO2和SO2,将NH3和CO2或SO2一起通入水中可生成碳酸盐或亚硫酸盐和水,反应方程式为CO2+2NH3+H2O=(NH4)2CO3或NH3+H2O+CO2=NH4HCO3,前者生成的盐为正盐,后者为酸式盐;
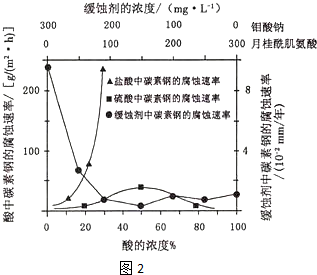
(4)①根据图象分析,在缓蚀剂中碳钢的腐蚀速率速率最小,腐蚀效果最好,最好的腐蚀效果在中点处;
②浓硫酸有强氧化性,能使金属表面形成致密的氧化膜保护层;
(5)根据电池放电时的正极MoS2得电子发生还原反应书写;利用途径I,使所有的Mo转化为钼酸钠晶体,根据得失电子守恒计算.
解答 解:(1)A.合金是指由一种金属与其它金属或非金属熔合而成的具有金属特性的混合物.一般说来合金的硬度一般比各成分金属大,多数合金的熔点 低于组成它的成分金属的熔点,所以锆合金比纯锆的熔点低,硬度大,故A错误;
B.陶瓷属于无机非金属材料,二氧化锆陶瓷属于新型无机非金属材料,故B正确;
C.将一束光线通过胶体会产生一条光亮的通路,但二氧化锆为化合物无丁达尔效应,故C错误;
故答案为:B;
(2)①途径I碱浸时发生反应的离子方程式为MoO3+CO32-=MnO42-+CO2↑,故答案为:MoO3+CO32-=MoO42-+CO2↑;
②途径Ⅱ用NaClO在碱性条件下氧化MoO3,发生反应的离子方程式为MnS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O,故答案为:MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;
(3)四钼酸铵[(NH4)2MoO4]和氢氧化钠反应可生成NH3,途径Ⅰ中生成的气体有CO2和SO2,CO2和NH3一起通入水中生成的正盐为碳酸铵,化学式为(NH4)2CO3,如果是SO2气体则生成正盐为(NH4)2SO3,故答案为:(NH4)2CO3或(NH4)2SO3;
(4)①根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好,即浓度比为1:1,答案为:1:1;
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是常温下浓硫酸具有强氧化性,会使铁钝化,起到防腐蚀作用,
故答案为:常温下浓硫酸具有强氧化性,会使铁钝化;
(5)放电时,正极应是发生还原反应的,从总反应式中找到发生还原反应的物质为MoS2,而被还原的产物为Lix(MoS2)n,则电极反应式为:nMoS2+xLi++xe-=Lix(MoS2)n,a克的Na2MoO4•2H2O(分子量为M)中Mo的物质的量为$\frac{a}{M}$mol,途径I用Lix(MoS2)n,被空气氧化成MoO3,根据电子得失守恒有关系式$\frac{14n+x}{4}$O2~nMoO3,所以需要需要空气(含O2为20%)在标况下的体积为$\frac{14n+x}{4n}×\frac{a}{M}÷50%÷20%×22.4L$=$\frac{56(14n+x)a}{nM}$L,
故答案为:nMoS2+xLi++xe-=Lix(MoS2)n;$\frac{56(14n+x)a}{nM}$.
点评 本题考查制备钼酸钠晶体的工业制备方法,涉及利用化学用语分析反应原理,解题关键是分析题中图示,最后一问有一定的难度,容易出错,本题难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 容器内气体压强不随时间变化 | |
| B. | 容器内气体密度不随时间变化 | |
| C. | 容器内X、Y、Z的浓度之比为1:2:2 | |
| D. | X的消耗速率和Z的生成速率之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平.请回答下列问题.
乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平.请回答下列问题. ,结构简式H2C=CH2.
,结构简式H2C=CH2. ,反应类型是加聚反应.
,反应类型是加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
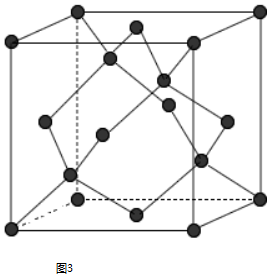
 ;亚铜离子(Cu+)基态时的电子排布式为1s22s22p63s23p63d10或[Ar]3d10.
;亚铜离子(Cu+)基态时的电子排布式为1s22s22p63s23p63d10或[Ar]3d10.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
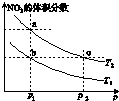 在密闭容器中充入一定量的NO2,发生反应2NO2(g)?N2O4(g)△H=-57kJ•mol-1.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示.下列说法正确的是( )
在密闭容器中充入一定量的NO2,发生反应2NO2(g)?N2O4(g)△H=-57kJ•mol-1.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示.下列说法正确的是( )| A. | a、c两点的反应速率:a>c | B. | 由a点到b点,可以用加热的方法 | ||
| C. | a、c两点气体的颜色:a深,c浅 | D. | a、b两点NO2的转化率:a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
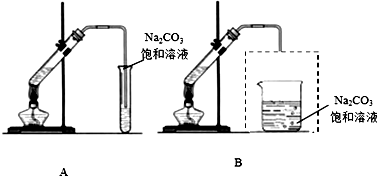
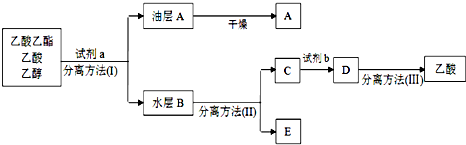
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.7mol/L | B. | 12.7mol/L | C. | 13.7mol/L | D. | 14.7mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com