
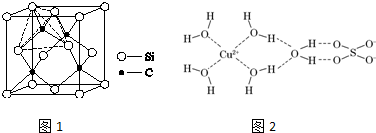
 ;亚铜离子(Cu+)基态时的电子排布式为1s22s22p63s23p63d10或[Ar]3d10.
;亚铜离子(Cu+)基态时的电子排布式为1s22s22p63s23p63d10或[Ar]3d10. 分析 (1)同一周期中元素的第一电离能随着原子序数的增大而呈增大的趋势,但第VA族元素大于其相邻元素;
(2)根据价层电子对互斥理论确定其杂化方式,提供空轨道的原子和提供孤电子对的原子之间形成配位键;第VA族元素大于其相邻元素的第一电离能;
(3)一个晶胞中的硅原子数目为$\frac{1}{8}×8$+6×$\frac{1}{2}$+4=8,令硅原子之间的距离为a,则晶胞体积v=a3,以此计算;
(4)水合铜离子中铜离子提供空轨道,水分子中氧原子提供孤电子对,形成配位键;电子排布式依据构造原理.
解答 解:(1)As、Se、Br属于同一周期且原子序数逐渐增大,这三种元素依次属于第IVA族、第VA族、第VIA族,第VA族元素大于其相邻元素的第一电离能,所以3种元素的第一电离能从大到小顺序为Br>As>Se,
故答案为:Br>As>Se;
(2)BF3•NH3中B原子含有3个σ 键一个配位键,所以其价层电子数是4,B原子采取sp3杂化,该化合物中,B原子提供空轨道的原子、N原子提供孤电子对,所以B、N原子之间形成配位键;第VA族元素大于其相邻元素的第一电离能,第一电离能介于B、N之间的元素除C外,还有O;
故答案为:sp3;配位;O;
(3)单晶硅与金刚石结构相似,即硅原子位于晶胞的顶点,面心和内部,则由均摊法知一个晶胞中的硅原子数目为$\frac{1}{8}×8$+6×$\frac{1}{2}$+4=8.令硅原子之间的距离为a,则晶胞体积v=a3,由v=$\frac{m}{ρ}$,晶胞质量为8个硅原子的质量m=$\frac{28×8}{{N}_{A}}$g,则ρ=$\frac{\frac{28×8}{{N}_{A}}}{{a}^{3}}$,a=$\root{3}{\frac{224}{{N}_{A}ρ}}$cm,
每个碳原子连接4个硅原子,每个硅原子又连接其他3个碳原子,所以每个碳原子周围最近的碳原子数目为3×4=12,
故答案为:$\root{3}{\frac{224}{{N}_{A}ρ}}$cm;12;
(4)水合铜离子中铜离子提供空轨道,水分子中氧原子提供孤电子对,形成配位键,配体数为4,则水合铜离子的结构简式为: ;铜是29号元素,根据构造原理,铜原子基态原子核外电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,则亚铜离子基态电子排布式为1s22s22p63s23p63d10或[Ar]3d10
;铜是29号元素,根据构造原理,铜原子基态原子核外电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,则亚铜离子基态电子排布式为1s22s22p63s23p63d10或[Ar]3d10
故答案为: ;1s22s22p63s23p63d10 或[Ar]3d10.
;1s22s22p63s23p63d10 或[Ar]3d10.
点评 本题综合考查原子结构与元素周期率知识,为高考常见题型,涉及第一电离能大小顺序,杂化方式,晶体密度计算及晶胞结构,配合物成键状况及配合物结构简式的书写,以及原子的核外电子排布式,题目难度中等,晶体密度及结构相对较难.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | KCl | B. | Na2S | C. | (NH4)2SO4 | D. | BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 | Fe2+具有还原性 | |
| ② | 在FeCl2溶液中加入锌片 | (不写) | Zn+Fe2+═Zn2++Fe | |
| ③ | 在FeCl3溶液中加入足量铁粉 | Fe+2Fe3+═3Fe2+ | Fe3+具有氧化性 | |
| ④ | (不写) | Fe3+具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定 序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | V | 0.50 | 25.80 | 25.30 |
| 2 | V | 6.00 | 31.35 | 25.35 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
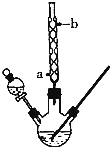 某化学课外小组设计了如图所示的装置制取乙酸乙酯(图中夹持仪器和加热装置已略去).请回答下列问题:
某化学课外小组设计了如图所示的装置制取乙酸乙酯(图中夹持仪器和加热装置已略去).请回答下列问题:| 乙醇 | 乙酸 | 乙酸乙酯 | 98%浓硫酸 | |
| 熔点/℃ | -117.3 | 16.6 | -83.6 | - |
| 沸点/℃ | 78.5 | 117.9 | 77.5 | 338.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com