
| A. | KCl | B. | Na2S | C. | (NH4)2SO4 | D. | BaSO4 |
分析 A.氧化钾与盐酸可发生反应KCl;
B.氧化钠与氢硫酸反应生成硫化钠;
C.一水合氨与三氧化硫反应生成硫酸铵;
D.氧化钡与硫酸反应、氢氧化钡与三氧化硫均反应生成硫酸钡.
解答 解:A.KCl不能由“酸性氧化物+碱”制取,故A不选;
B.Na2S不能由“酸性氧化物+碱”制取,故B不选;
C.(NH4)2SO4不能由“碱性氧化物+酸”制取,故C不选;
D.BaSO4既可以用“碱性氧化物+酸”制取,也可以用“酸性氧化物+碱”制取,氧化钡与硫酸反应、氢氧化钡与三氧化硫均反应生成硫酸钡,故D选;
故选D.
点评 本题考查物质的性质及反应,为高频考点,把握酸、碱及氧化物的性质为解答的关键,侧重分析与应用能力的考查,注意发生的复分解反应,题目难度不大.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 容器内气体压强不随时间变化 | |
| B. | 容器内气体密度不随时间变化 | |
| C. | 容器内X、Y、Z的浓度之比为1:2:2 | |
| D. | X的消耗速率和Z的生成速率之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0g重水(D2O)中含有的中子数为NA | |
| B. | 标准状况下22.4L的四氯化碳,含有四氯化碳分子数为NA | |
| C. | 23g金属钠变为钠离子时失去的电子数为NA | |
| D. | 常温常压下,48gO3和O2混合气体中含有的氧原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑦⑧⑨ | B. | ①④⑦⑧⑨⑩ | C. | ①③④⑥⑨⑩ | D. | ①②④⑤⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③④ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
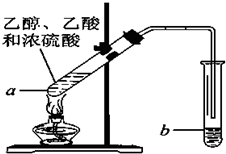 乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平.请回答下列问题.
乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平.请回答下列问题. ,结构简式H2C=CH2.
,结构简式H2C=CH2. ,反应类型是加聚反应.
,反应类型是加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
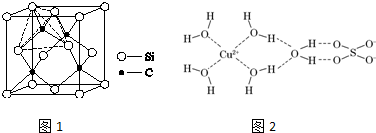
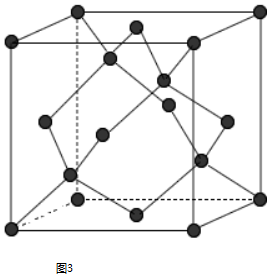
 ;亚铜离子(Cu+)基态时的电子排布式为1s22s22p63s23p63d10或[Ar]3d10.
;亚铜离子(Cu+)基态时的电子排布式为1s22s22p63s23p63d10或[Ar]3d10.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com