
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:解答题
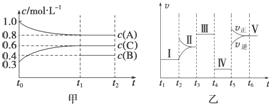 向某密闭容器中加入 4mol A、1.2mol C 和一定量的 B 三种气体,一定条件 下发生反应,各物质的浓度随时间变化如甲图所示[已知 t0~t1 阶段保持恒温、恒容,且 c(B)未画出].乙图为 t2 时刻后改变反应条件,反应速率随时间的变化情况,已知 在 t2、t3、t4、t5 时刻各改变一种不同的条件,其中 t3 时刻为使用催化剂.
向某密闭容器中加入 4mol A、1.2mol C 和一定量的 B 三种气体,一定条件 下发生反应,各物质的浓度随时间变化如甲图所示[已知 t0~t1 阶段保持恒温、恒容,且 c(B)未画出].乙图为 t2 时刻后改变反应条件,反应速率随时间的变化情况,已知 在 t2、t3、t4、t5 时刻各改变一种不同的条件,其中 t3 时刻为使用催化剂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中的还原剂是S2O32- | |
| B. | 该反应的氧化产物是Cl- | |
| C. | 上述反应中,每生成1 mol SO42-,可脱去2 mol Cl2 | |
| D. | 根据该反应可判断氧化性:Cl2>SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ | |
| B. | 已知4P(红磷,s)=P4(白磷,s);△H>0,则白磷比红磷稳定 | |
| C. | 含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l);△H=-57.4kJ/mol | |
| D. | 己知C(s)+O2 (g)=CO2(g);△H1 2C(s)+O2(g)=2CO(g);△H2 则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl | B. | Na2S | C. | (NH4)2SO4 | D. | BaSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com