
| A. | 该反应中的还原剂是S2O32- | |
| B. | 该反应的氧化产物是Cl- | |
| C. | 上述反应中,每生成1 mol SO42-,可脱去2 mol Cl2 | |
| D. | 根据该反应可判断氧化性:Cl2>SO42- |
分析 反应的离子方程式为S2O32-+4Cl2+10OH-=2SO42-+8Cl-+5H2O,从化合价变化的角度判断氧化还原反应中电子转移情况,化合价升高元素所在的反应物是还原剂,化合价降低元素所在的反应物是氧化剂,氧化剂的氧化性强于氧化产物的氧化性,由此分析解答.
解答 解:反应的离子方程式为S2O32-+4Cl2+10OH-=2SO42-+8Cl-+5H2O,则
A.反应中S元素的化合价升高,被氧化,则S2O32-为还原剂,故A正确;
B.氧化产物是硫酸根离子,而不是氯离子,故B错误;
C.由反应的方程式可知,每生成lmolSO42-,可脱去2molCl2,故C正确;
D.氧化剂氧化性大于氧化产物的氧化性,反应中氧化性:Cl2>SO42-,故D正确.
故选B.
点评 本题考查氧化还原反应,题目难度中等,解答该题的关键是能够写出反应的离子方程式.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
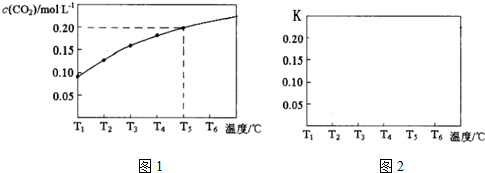
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
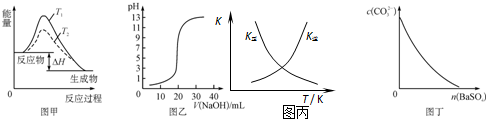
| A. | 图甲表示温度T1>T2,SO2与O2反应过程中的能量变化 | |
| B. | 图乙表示0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L CH3COOH溶液所得到的滴定曲线 | |
| C. | 图丙表示恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化 | |
| D. | 图丁表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的浓度变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡前,随着反应的进行,容器内压强始终不变 | |
| B. | 平衡时,其他条件不变,分离出硫,正反应速率加快 | |
| C. | 平衡时,若升高温度,CO体积分数增大,则该反应的△H>0 | |
| D. | 其他条件不变,使用不同催化剂,该反应平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只具有氧化性 | B. | 只具有还原性 | ||
| C. | 既有氧化性也有还原性 | D. | 既无氧化性也无还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积 ②>③>①>④ | B. | 密度 ②>③>④>① | ||
| C. | 质量 ②>③>④>① | D. | 氢原子个数 ①>③>④>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3、K2CO3 | B. | AgNO3、K2CO3、HNO3 | ||
| C. | K2CO3、AgNO3 | D. | K2CO3、AgNO3、HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内气体压强不随时间变化 | |
| B. | 容器内气体密度不随时间变化 | |
| C. | 容器内X、Y、Z的浓度之比为1:2:2 | |
| D. | X的消耗速率和Z的生成速率之比为1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com