
常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-,已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是____________;所含阴离子相同的两种盐的化学式是__________________。
(2)D的化学式为__________________,D溶液显碱性的原因是_________________(用离子方程式表示)。
(3)A和C的溶液反应的离子方程式是______________________________________;
E和氨水反应的离子方程式是____________________________________________。
(4)若要检验B中所含的阳离子,正确的实验方法是______________________________。
(1)Cu2+、Fe3+ (NH4)2SO4、Al2(SO4)3
(2)Na2CO3 CO32-+H2O HCO3-+OH-
HCO3-+OH-
(3)Ag++Cl-=AgCl↓ Al3++3NH3·H2O=Al(OH)3↓+3NH4+
(4)取少量B于试管中,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸放在试管口,观察是否变蓝色
【解析】由于盐溶液没有颜色,所以没有Cu2+和Fe3+;根据实验现象可知,A、B、C、D、E分别为BaCl2、(NH4)2SO4、AgNO3、Na2CO3、Al2(SO4)3;检验NH4+,常用的方法是将铵盐与浓NaOH溶液共热,看是否能够产生使湿润的红色石蕊试纸变蓝的气体。


科目:高中化学 来源:2014高考化学二轮专题突破 专题十五综合实验探究练习卷(解析版) 题型:实验题
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验,可选用试剂:KSCN溶液、K3[Fe(CN)6]溶液、氯水。
(1)请完成下表:
操作 | 现象 | 结论 |
取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 |
| 存在Fe3+ |
取少量除尽Ag+后的溶液于试管中,加入________,振荡 |
| 存在Fe2+ |
【实验结论】 Fe的氧化产物为Fe2+和Fe3+。
Ⅱ.AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束后,试管中残留固体为黑色。
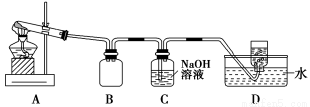
(2)装置B的作用是________。
(3)经小组讨论并验证该无色气体为O2,其验证方法是________。
(4)【查阅资料】 Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水。
【提出设想】 试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag和Ag2O。
【实验验证】 该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实验。
实验编号 | 操作 | 现象 |
a | 加入足量氨水,振荡 | 黑色固体不溶解 |
b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验评价】 根据上述实验,不能确定固体产物成分的实验是________(填实验编号)。
【实验结论】 根据上述实验结果,该小组得出AgNO3固体热分解的产物有________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十一常见金属元素练习卷(解析版) 题型:选择题
工业上冶炼金属一般用热分解法、热还原法和电解法,不同的金属应选用不同的冶炼方法。选择的原则主要是依据( )
A.金属在地壳中的丰度
B.金属在自然界中的存在形式
C.金属的还原性强弱
D.金属的利用价值
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题八电化学练习卷(解析版) 题型:填空题
海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
含量/mg·L-1 | 9 360 | 83 | 200 | 1 100 | 16 000 | 1 200 | 118 |
(1)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过。
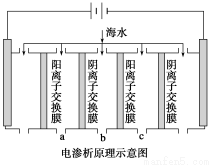
①阴极的电极反应式为__________________。
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式______________________________________。
③淡水的出口为a、b、c中的________出口。
(2)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如下图所示:
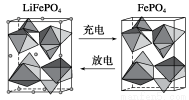
该电池电解质为传导Li+的固体材料。放电时该电极是电池的________极(填“正”或“负”),电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题八电化学练习卷(解析版) 题型:选择题
在下列装置中,MSO4和NSO4是两种常见金属的易溶盐。当K闭合时,SO42-从右到左通过交换膜移向M极,下列分析正确的是( )
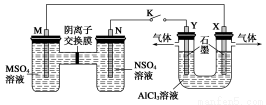
A.溶液中c(M2+)减小
B.N的电极反应式:N=N2++2e-
C.X电极上有H2产生,发生还原反应
D.反应过程中Y电极周围生成白色胶状沉淀
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题五离子反应练习卷(解析版) 题型:选择题
水溶液中能大量共存的一组离子是( )
A.Na+、Al3+、Cl-、CO32- B.H+、Na+、Fe2+、MnO4-
C.K+、Ca2+、Cl-、NO3- D.K+、NH4+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题二化学用语及常用计量练习卷(解析版) 题型:实验题
某学生利用高锰酸钾分解制氧气的反应,测定室温下的气体摩尔体积,实验装置如下。
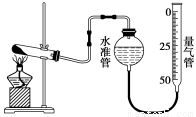
部分实验步骤:①装好实验装置。② _。
③把适量的高锰酸钾粉末放入干燥的试管中,准确称量试管和高锰酸钾粉末的质量为
a g。④加热,开始反应,直到产生一定量的气体。⑤停止加热。⑥测量收集到的气体的体积。⑦准确称量试管和残留物的质量为b g。⑧测量实验室的温度。回答下列问题。
(1)实验步骤的第②步是 _。
(2)以下是测量收集到的气体的体积时必须包括的几个步骤:①调整量气管高度,使其液面高度与水准管液面高度相平;②使装置内的气体都冷却至室温;③读取量气管中气体的体积。这三步操作的正确顺序是 (请填写步骤代号)。
(3)如果实验中得到的氧气体积是c L,水蒸气的影响忽略不计,则室温下气体摩尔体积的计算式为 (含a、b、c)。
(4)分析下列因素对实验结果的影响(假定其他操作均正确),并在横线上填“偏大”、“偏小”或“无影响”。
①高锰酸钾未完全分【解析】
_。
②实验前未将装置内的空气排出: _。
③未恢复至室温就读数: _。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题九化学反应速率化学平衡练习卷(解析版) 题型:选择题
某温度时,在密闭容器中,X、Y、Z三种气体浓度的变化如图Ⅰ所示,若其它条件不变,当温度分别为T1和T2时,Y的体积分数与时间关系如图Ⅱ所示。则下列结论正确的是( )
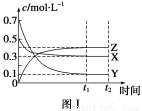
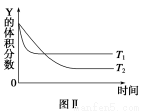
A.该反应的热化学方程式为X(g)+3Y(g)  2Z(g) ΔH>0
2Z(g) ΔH>0
B.若其它条件不变,升高温度,正、逆反应速度均增大,X的转化率减小
C.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动
D.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题一物质的组成性质和分类练习卷(解析版) 题型:选择题
下图是某反应在密闭容器中反应前后的分子状况示意图,“●”和“○”分别表示不同的原子。下列对该过程的相关描述正确的是( )
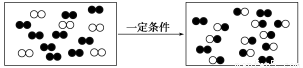
A.有一种物质过量 B.发生的是分解反应
C.发生的是置换反应 D.生成了两种产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com