
| A. | 金属Na熔沸点高于金属K | |
| B. | 非金属性N>P,但是单质活泼性:氮气<白磷 | |
| C. | 相同条件下,NH3在水中的溶解度大于PH3 | |
| D. | SiC晶体的熔点比晶体硅的高 |
分析 A、Na、K随原子序数逐渐增大,金属键减弱,熔点依次降低;
B、氮气中含有N≡N,键能大,分子稳定;
C、氨分子与水分子间易形成氢键;
D、SiC晶体和晶体硅都属于原子晶体,其熔点由键能决定.
解答 解:A、钠的金属键强于钾的金属性,所以熔沸点:Na>K,与键能有关,故A正确;
B、氮气中含有N≡N,键能大,分子稳定,所以氮元素的非金属性比磷元素的非金属性强,但N2很稳定,与化学键有关,故B正确;
C、氨分子与水分子间易形成氢键,而不PH3与水分子间不形成氢键,与化学键无关,故C错误;
D、SiC晶体和晶体硅都属于原子晶体,其熔点由键能决定,键能越大熔点越高,故D正确.
故选:C.
点评 本题考查键能的应用,涉及物质熔沸点的判断、溶解度大小比较等知识,难度不大,注意概念的理解应用.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
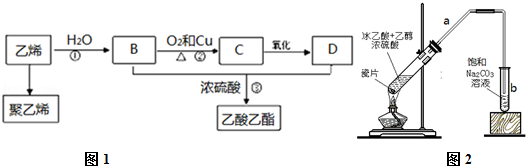
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA | |
| B. | 78 g Na2O2固体中含有的阴离子数为NA | |
| C. | 标准状况下,11.2 L CH3OH中含有的分子数目为0.5NA | |
| D. | 常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol 甲基(-CH3)所含电子数为0.07NA | |
| B. | 标准状况下,2.24L CH3Cl中所含分子数为0.1NA | |
| C. | 常温常压下,0.1mol/L CH3CH2OH溶液中含有的碳原子数目为0.2NA | |
| D. | 10 mL 0.1 mol/L HCHO溶液与足量的银氨溶液完全反应,转移电子的数目为2×10-3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷可用作燃料,说明甲烷燃烧是释放能量的反应 | |
| B. | 生成物总能量一定低于反应物总能量 | |
| C. | 干冰气化需要吸收大量的热,这个变化是吸热反应 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加工后具有吸水性的植物纤维可用作食品干燥剂 | |
| B. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| C. | 以淀粉为原料可制取乙酸乙酯 | |
| D. | 食用花生油和鸡蛋清都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 现代元素周期表中,元素按照元素的相对原子质量递增顺序排列 | |
| B. | 第ⅠA族元素的金属性比第ⅡA族元素的金属性强 | |
| C. | 在元素周期表中金属与非金属的分界线附近,可以找到半导体材料 | |
| D. | 室温时,第IA族元素的单质都是固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠与水反应:Na+H2O=Na++H2+OH- | |
| B. | 氯化铵溶液显酸性的原因:NH4++H2O=NH3•H2O+H+ | |
| C. | AlCl3溶液中加入足量氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 氯化铁溶液中滴加少量的硫化氢溶液:2Fe3++H2S=2Fe2++S+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
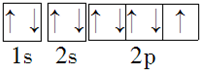
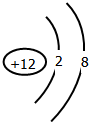
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com