
| A、臭氧与氧气的混合气体4.8g中所含有的原子总数为0.3NA |
| B、标准状况下,2.24L单质气体中含有原子数为0.2NA |
| C、在常温常压下,3.4gNH3含有的电子数是2NA |
| D、含5.4 gAl3+的硫酸铝溶液中,含有的SO42-的数目是0.3NA |
| m |
| M |
| 4.8g |
| 16g/mol |


 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案科目:高中化学 来源: 题型:
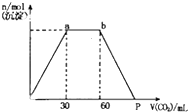 向Ba(OH)2和KOH混合液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体体积VmL的关系如图所示,下列结论中正确的是( )
向Ba(OH)2和KOH混合液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体体积VmL的关系如图所示,下列结论中正确的是( )| A、原混合物中n[Ba(OH)2]:n(KOH)=1:2 |
| B、p点坐标为120mL |
| C、p点溶液中溶质为Ba(HCO3)2 |
| D、a,b段反应分二阶段,离子方程式为:CO2+2OH-=CO32-+H2O CO32-+H2O+CO2=2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H>0表示放热反应,△H<0表示吸热反应 |
| B、热化学方程式中的化学计量数只表示物质的量,可以是分数 |
| C、1mol H2SO4与1mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
| D、1mol H2与0.5molO2反应放出的热就是H2的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应中,氧化剂与还原剂物质的量之比为9:5 | ||
B、当反应中有1mol电子转移时,被还原氯气物质的量为
| ||
| C、每产生1mol O2时,被氧元素还原的氯气物质的量为2mol | ||
D、参加反应的水有
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| C |
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| C |
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:
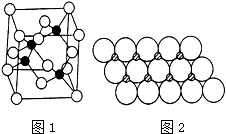 Ⅰ.砷化镓为第三代半导体,以其为材料制造的灯泡寿命长、耗能少.已知砷化镓的晶胞结构如图1所示.请回答下列问题:
Ⅰ.砷化镓为第三代半导体,以其为材料制造的灯泡寿命长、耗能少.已知砷化镓的晶胞结构如图1所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

| A、分子中所有的原子共面 |
| B、1 mol EGC与4 mol NaOH恰好完全反应 |
| C、遇Fe发生显色反应 |
| D、易发生氧化反应和取代反应,相对较难发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com