
【题目】X、Y、Z、W、U五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57.Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,U原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.
(1)U2+的外围电子排布式为________.
(2)X、Y、Z 可以形成化学式为XYZ的分子.该分子中各原子均达到稀有气体稳定结构,则该分子中Y采取的杂化轨道类型为__________.
(3)比较Y和W的第一电离能,较大的是__________(填元素符号).

(4)X与Z形成的最简单化合物Q的分子构型为__________;
(5)U+与Z3﹣形成的晶胞结构如图所示,阴、阳离子间的核间距为acm.与同一个Z3﹣相连的U+有________个,该晶体的密度为__________ g·cm﹣3.(设NA表示阿伏加德罗常数)
【答案】 3d9 sp C 三角锥形 6 ![]() 或
或![]()
【解析】X、Y、Z、W、U五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57,Y原子的L层p轨道中有2个电子,则Y为C元素;Z的原子核外有三个未成对电子,Z原子序数大于Y,W与Y原子的价电子数相同,W原子序数大于Z,所以W是Si元素、Z为N元素;U原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态,则U为Cu元素,根据核电荷数知,X是H元素;
(1)U2+为Cu2+,其3d能级上9个电子为其外围电子,据此书写其外围电子排布式为3d9;
(2)H、C、N可以形成化学式为HCN的分子.该分子中各原子均达到稀有气体稳定结构,则该分子中C原子价层电子对个数是2且不含孤电子对,根据价层电子对互斥理论判断C原子采取的杂化方式为sp;
(3)Y是C、W是Si元素,二者处于同一主族,同一主族元素第一电离能随着原子序数增大而减小,所以第一电离能较大的是C;
(4)H与N形成的最简单化合物NH3的分子构型为三角锥形;
(5)Cu+与N3-形成的晶胞结构如图所示,则晶胞边长为2acm,该晶胞中灰色球个数=8×![]() =1、黑色球个数=12×
=1、黑色球个数=12×![]() =3,根据化合价知,灰色球表示氮离子、黑色球表示亚铜离子,与同一个N3-相连的Cu+有6个,该晶体的密度=
=3,根据化合价知,灰色球表示氮离子、黑色球表示亚铜离子,与同一个N3-相连的Cu+有6个,该晶体的密度=![]() =
=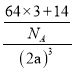 gcm-3=
gcm-3=![]() gcm-3。
gcm-3。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)2017年中科院某研究团队通过设计一种新型Na-Fe3O4/HZSM-5多功能符合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
已知:H2(g)+1/2O2(g)=H2O(l) ΔH1=-285.8kJ/mol
C8H18 (1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH3=-5518kJ/mol
试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式________
(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有:
甲:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-53.7 kJ·mol-1平衡常数 K1
CH3OH(g)+H2O(g) △H=-53.7 kJ·mol-1平衡常数 K1
乙:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H=+41.2 kJ·mol-1平衡常数K2
CO(g)+H2O(g) △H=+41.2 kJ·mol-1平衡常数K2
①CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应H_____0(填“大于”或“小于”)。
CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应H_____0(填“大于”或“小于”)。
②提高CO2转化为CH3OH平衡转化率的措施有___________(填写两项)。
③催化剂和反应体系的关系就像锁和钥匙的关系一样,具有高度的选择性。下列四组实验,控制CO2和H2初始投料比均为1:2.2,经过相同反应时间(t1min)
温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) | 综合选项 |
543 | Cu/ZnO纳米棒材料 | 12.3 | 42.3 | A |
543 | Cu/ZnO纳米片材料 | 11.9 | 72.7 | B |
553 | Cu/ZnO纳米棒材料 | 15.3 | 39.1 | C |
553 | Cu/ZnO纳米片材料 | 12.0 | 71.6 | D |
由表格中的数据可知,相同温度下不同的催化剂对CO2的转化为CH3OH的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为___________(填字母符号)。
(3)以CO、H2为原料合成甲醇的反应为:CO(g)+2H2(g)=CH3OH(g)。在体积均为2L的三个恒容密闭Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。图1为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。CO的平衡转化率在不同压强下随温度的变化如图所示。

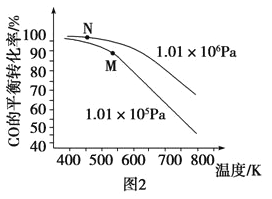
①0~5 min时间内容器Ⅱ中用CH3OH表示的化学反应速率为__________。
②三个容器中一定达到平衡状态的是容器________(填写容器代号)。
③工业实际合成CH3OH生产中,采用图2中M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡及其化合物在生产、生活中有着重要的用途。己知:酸性条件下,锡在水洛液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化、易水解生成碱式氯化亚锡(Sn(OH)Cl);SnCl4极易水解。请按要求回答下列相关问题:
(1)锡原子的核电荷数为50,锡的原子结构示意图为________________。
(2) SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因____________。
SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为______________。
(3)硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
①操作Ⅰ是___________。
②加入Sn粉的作用有两个:a.调节溶液pH; b.__________.
③反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是______________。
(4)锡粉可用于微电子器件生产,该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将1.2g试样溶于盐酸中,发生的反应为:Sn+2HCl=SnCl2+H2↑;②加入过量的FeCl3;③用0.1 mol/L的K2Cr2O7滴定生成的Fe2+ (己知酸性环境下,Cr2O72-可被还原为Cr3+),共用去K2Cr2O7溶液32mL。则锡粉中锡的质量分数是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若以溴乙烷为主要原料制备乙二酸,则经过的最佳途径反应顺序为
A.取代—消去—加成—氧化B.消去—加成—取代—氧化
C.消去—取代—加成—氧化D.取代—加成—氧化—消去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一张照片,一只可爱的小猫站在一块高分子合成材料上,下面是烈火灼烧,而小猫却若无其事。这说明此高分子材料一定具有的性质是( )
A.良好的导热性B.良好的绝缘性C.良好绝热性D.熔点低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com