
����Ŀ�������仯������������������������Ҫ����;����֪�����������£�����ˮ��Һ����Sn2+��Sn4+������Ҫ������ʽ��Sn2+�ױ���������ˮ�����ɼ�ʽ�Ȼ�����(Sn(OH)Cl)��SnCl4����ˮ�⡣�밴Ҫ��ش�����������⣺
��1����ԭ�ӵĺ˵����Ϊ50������ԭ�ӽṹʾ��ͼΪ________________��
��2�� SnCl2��ĩ���Ũ��������ܽ⣬����ƽ���ƶ�ԭ������ԭ��____________��
SnCl4����������ˮ����Ũ��״�������������Ļ�����䷴Ӧ�Ļ�ѧ����ʽΪ______________��
��3����������(SnSO4)��һ����Ҫ�������Σ��㷺Ӧ���ڶ�����ҵ��ij�о�С�����SnSO4�Ʊ�·�����£�
�ٲ�������___________��
�ڼ���Sn�۵�������������a.������ҺpH�� b.__________.
�۷�Ӧ���õ�������SnO���õ��ó��������ӷ�Ӧ����ʽ��______________��
��4�����ۿ���������������������С��ͨ�����з����ⶨ�������۵Ĵ��ȣ����ʲ����뷴Ӧ����
�ٽ�1.2g�������������У������ķ�ӦΪ��Sn+2HCl=SnCl2+H2�����ڼ��������FeCl3������0.1 mol/L��K2Cr2O7�ζ����ɵ�Fe2+ (��֪���Ի����£�Cr2O72-�ɱ���ԭΪCr3+)������ȥK2Cr2O7��Һ32mL������������������������_____________��
���𰸡� 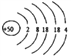 SnCl2+H2O=Sn(OH)Cl+HCl������������ʹ��ƽ�������ƶ�������Sn2+ˮ�� SnCl4+4NH3+4H2O=Sn(OH)4+4NH4C1 ����Ũ������ȴ�ᾧ�����ˡ�ϴ�������� ��ֹSn2+������ Sn2++CO32-=SnO��+CO2�� 95.2%
SnCl2+H2O=Sn(OH)Cl+HCl������������ʹ��ƽ�������ƶ�������Sn2+ˮ�� SnCl4+4NH3+4H2O=Sn(OH)4+4NH4C1 ����Ũ������ȴ�ᾧ�����ˡ�ϴ�������� ��ֹSn2+������ Sn2++CO32-=SnO��+CO2�� 95.2%
����������1����ԭ�ӵĺ˵����Ϊ50������ԭ�ӽṹʾ��ͼΪ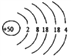 ��
��
��2�� SnCl2��ĩ���Ũ��������ܽ⣬ԭ��Ϊ�Ȼ���������ˮ����ˮ��ƽ����ڣ�SnCl2+H2O=Sn(OH)Cl+HCl���������ᣬʹ��ƽ�������ƶ�������Sn2+ˮ����SnCl4����������ˮ����Ũ��״�������������Ļ������ԭ�����Ȼ�����ˮ������ˮ�����������������Ȼ��⣬�Ȼ�����ˮ���γɰ������Ȼ��������������Ȼ�麟��ְ��̣���Ӧ�Ļ�ѧ����ʽΪSnCl4+4NH3+4H2O=Sn(OH)4+4NH4C1��
��3�����Ʊ�·��������Ϣ��֪���Ȼ��������ܺ������ۣ�һ���������Һ������ԣ���һ������Է�ֹ�Ȼ����������������˺�����Һ�м���̼�������Ȼ�������Һ��Ӧ����SnO�����˵õ�SnO��Ưϴ��������Ὣ���ܽ�õ�����������Һ��������Һ����Ũ�������½ᾧ�����ˡ�ϴ�ӡ�����õ�����������
�ٲ������Ǽ���Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ����
�ڼ���Sn�۵�������������a.������ҺpH�� b. ��ֹSn2+��������.
�۷�Ӧ��õ�������SnO���õ��ó��������ӷ�Ӧ����ʽ��Sn2++CO32-=SnO��+CO2����
��4���ⶨ�������۵Ĵ��ȣ����ʲ����뷴Ӧ�����ٽ�1.2g�������������У������ķ�ӦΪ��Sn+2HCl=SnCl2+H2�����ڼ��������FeCl3������0.1 mol/L��K2Cr2O7�ζ����ɵ�Fe2+ (��֪���Ի����£�Cr2O72-�ɱ���ԭΪCr3+)������ȥK2Cr2O7��Һ32mL��������֪���Ȼ��������Ȼ�����ԭΪ�Ȼ����������������ӷ�ӦΪSn2++2Fe3+=Sn4++2Fe2+��Ȼ��Fe2+�ֱ�Cr2O72-����ΪFe2+�����������ӷ�ӦΪCr2O72-+6 Fe2++14H+=2Cr3++6Fe3++7H2O���ɵ�3Sn~3 Sn2+~6Fe2+~ Cr2O72-������n(Sn)=n(Sn2+)= ![]() n(Cr2O72-)=
n(Cr2O72-)= ![]() =
= ![]() ��m(Sn)=
��m(Sn)= ![]() ������������������������
������������������������![]() =95.2% ��
=95.2% ��


 ��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������¹ʴ�������ȷ���ǣ� ��
A. ���������ƾ��ƣ������ľƾ�������ȼ��ʱ��Ӧ������ʪĨ���˸�
B. ��һ����̼�ж����Ƶ�ͨ�紦����
C. �۾��ﲻ��������ҩҺ��Ӧ������ˮ��ϴ����ϴ��գ�۾��������������۾�
D. ������Ũ���ὦ��Ƥ���ϣ�Ӧ������ˮ��ϴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����贿����NaCl���壬�����е�NaCL�����л���������Na2SO4��NH4HCO3 �� Ϊ��ȥ���ʣ���ͬѧ���������ʵ�飺����֪NH4HCO3 ![]() NH3+H2O+CO2 ��
NH3+H2O+CO2 �� 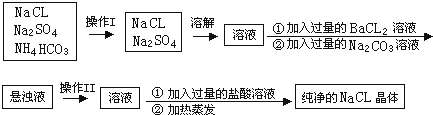
��1����������I��II�����Ʒֱ�Ϊ�� ��
��2�����в��������������BaCL2��Һ��ʱ������ж�BaCL2��Һ�ѹ������䷽���� ��
��3�����������������Na2CO3��Һ����Ŀ���� ��
��4�����������������������Һ����Ŀ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA���������ӵ�������ֵ������˵����ȷ���ǣ� ��
A.0.1mol��OH���к��еĵ�����Ϊ0.9NA
B.��״���£�11.2 L CCl4����������Ϊ0.5NA
C.6.02��1022�� CH4������ԭ����Ϊ0.4NA
D.���³�ѹ�£�28 g N2������ԭ�Ӹ���ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.�ҹ���ͨ��Ӳ�Ҳ����ǽ�������
B.���еIJ���ֶ�ֻ���н���Ԫ��
C.��ͭ���۵���ڽ���ͭ����Ӧ�ù㷺
D.þ�Ͻ��Ӳ�Ⱥͻ�еǿ�Ⱦ����ڴ�þ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��U����Ԫ�أ���λ�����ڱ���ǰ�����ڣ����ǵĺ˵�����������ӣ��Һ˵����֮��Ϊ57��Yԭ�ӵ�L��p�������2�����ӣ�Z��ԭ�Ӻ���������δ�ɶԵ��ӣ�W��Yԭ�ӵļ۵�������ͬ��Uԭ�ӵ�K�������������������֮��Ϊ2��1����d�������ȫ����״̬��
��1��U2+����Χ�����Ų�ʽΪ________��
��2��X��Y��Z �����γɻ�ѧʽΪXYZ�ķ��ӣ��÷����и�ԭ�Ӿ��ﵽϡ�������ȶ��ṹ����÷�����Y��ȡ���ӻ��������Ϊ__________��
��3���Ƚ�Y��W�ĵ�һ�����ܣ��ϴ����__________����Ԫ�ط��ţ���

��4��X��Z�γɵ��������Q�ķ��ӹ���Ϊ__________��
��5��U+��Z3���γɵľ����ṹ��ͼ��ʾ�����������Ӽ�ĺ˼��Ϊacm����ͬһ��Z3��������U+��________�����þ�����ܶ�Ϊ__________ g��cm��3������NA��ʾ�����ӵ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������ڱ�����̬�����������й����������Ĵ����������ǣ� ��
A.�Ͼɵ�ؾ͵�����B.�Ͼ�����¶����շ�ֹ������ɫ��Ⱦ
C.�ó���������������D.��ҽ�������еķ���������һ����ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���һ������ĺ����ܱ������н��п��淴Ӧ��X(g)+Y(g![]() Z(g) + W(s) ��H>0������������ȷ����
Z(g) + W(s) ��H>0������������ȷ����
A. ��������Z���淴Ӧ��������
B. ������������ѹǿ����ʱ����Ӧ�ﵽƽ��
C. �����¶ȣ�ƽ�����淴Ӧ�����ƶ�
D. ƽ�����X���÷�Ӧ����H����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com