
����Ŀ��ʵ�����贿����NaCl���壬�����е�NaCL�����л���������Na2SO4��NH4HCO3 �� Ϊ��ȥ���ʣ���ͬѧ���������ʵ�飺����֪NH4HCO3 ![]() NH3+H2O+CO2 ��
NH3+H2O+CO2 �� 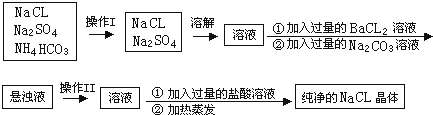
��1����������I��II�����Ʒֱ�Ϊ�� ��
��2�����в��������������BaCL2��Һ��ʱ������ж�BaCL2��Һ�ѹ������䷽���� ��
��3�����������������Na2CO3��Һ����Ŀ���� ��
��4�����������������������Һ����Ŀ���� ��
���𰸡�
��1�����ȣ�����
��2��ȡ�����ϲ���Һ���Թ��еμ��Ȼ�����Һ�������֣���˵���Ȼ�����Һ����
��3����ȥ�����ı�����
��4����ȥ������̼����
���������⣺NaCl�����л���������Na2SO4��NH4HCO3 �� ���ȹ���̼����立ֽ����ɰ�����������̼��ˮ�������õ��Ȼ��ƺ������ƣ�����ˮ�õ���Һ����������Ȼ���������������ӣ��������̼������Һ���˳�ȥ���ᱵ��̼�ᱵ��������Һ�м������������Һ��ȥ̼���ƣ�����������ȥ�Ȼ���õ��Ȼ��ƾ��壻��1��������Ϊ���ȷֽ�̼����泥���������˳�ȥ���ᱵ��̼�ᱵ�������ʴ�Ϊ�����ȣ����ˣ���2�����в��������������BaCL2��Һ��ʱ���ж�BaCL2��Һ�ѹ���������ȡ�ϲ���Һ�����Ȼ��ƿ��Ƿ��г��������ж��Ȼ����Ƿ�����������ֳ���֤��δ������������֤���Ȼ��������� �ʴ�Ϊ��ȡ�����ϲ���Һ���Թ��еμ��Ȼ�����Һ�������֣���˵���Ȼ�����Һ��������3���������̼������Һ��Ϊ�˳�ȥ�������Ȼ������ʴ�Ϊ����ȥ�����ı����ӣ���4���������̷�����֪��������������ȥ���������̼���ƣ��ʴ�Ϊ����ȥ������̼���ƣ�
NaCl�����л���������Na2SO4��NH4HCO3 �� ���ȹ���̼����立ֽ����ɰ�����������̼��ˮ�������õ��Ȼ��ƺ������ƣ�����ˮ�õ���Һ����������Ȼ���������������ӣ��������̼������Һ���˳�ȥ���ᱵ��̼�ᱵ��������Һ�м������������Һ��ȥ̼���ƣ�����������ȥ�Ȼ���õ��Ȼ��ƾ��壻��1��������Ϊ���ȷֽ�̼����泥���������˳�ȥ���ᱵ��̼�ᱵ��������2�����в��������������BaCL2��Һ��ʱ���ж�BaCL2��Һ�ѹ��������Լ����Ȼ��ƿ��Ƿ��г��������ж��Ȼ����Ƿ��������3���������̼������Һ��Ϊ�˳�ȥ�������Ȼ�������4��������������ȥ���������̼���ƣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�����ӹ������һ���豸�����ܽ����յķϾ����ϵȡ���ɫ��Ⱦ����ӹ������ͣ�ú�͵ȡ�����Ϊ�ӹ������з�������Ҫ��Ӧ��
A.����B.����C.����D.�ѻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��������A��B��C������ͼ��ʾ��ת����ϵ������H����H1+��H2����A��C������( )

��Fe��FeCl3 ��C��CO2 ��AlCl3��NaAlO2 ��NaOH��NaHCO3 ��S��CuS ��Na2CO3��CO2
A���ڢۢܢ� B���ڢۢܢݢ� C���٢ڢۢܢ� D���٢ڢۢܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ħ���� ( )
A. ���������������� B. ��ʾ���������ĵ�λ
C. ��ʾ���ʵ����ĵ�λ D. �������ʵ�������λ�������������ĵ�λ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ���һ���֡�
̼ | �� | Y | |
X | �� | Z |
�ش��������⣺
��1��ZԪ�������ڱ��е�λ��Ϊ__________________��
��2������Y�����Z����Ԫ�صļ����Ӱ뾶�ɴ�С��˳���ǣ������ӷ��ţ�____________��
��3��������ʵ��˵��YԪ�صķǽ����Ա�SԪ�صķǽ�����ǿ����__________��
a.Y������H2S��Һ��Ӧ����Һ�����
b.��������ԭ��Ӧ�У�1mol Y���ʱ�1mol S�õ��Ӷ�
c.Y��S��Ԫ�صļ��⻯�����ȷֽ⣬ǰ�ߵķֽ��¶ȸ�
��4��̼��þ�γɵ�1mol������Q��ˮ��Ӧ������2mol Mg(OH)2��1mol��̬��������������̼��������Ϊ9��1�����ĵ���ʽΪ__________________��Q��ˮ��Ӧ�Ļ�ѧ����ʽΪ__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯������������������������Ҫ����;����֪�����������£�����ˮ��Һ����Sn2+��Sn4+������Ҫ������ʽ��Sn2+�ױ���������ˮ�����ɼ�ʽ�Ȼ�����(Sn(OH)Cl)��SnCl4����ˮ�⡣�밴Ҫ��ش�����������⣺
��1����ԭ�ӵĺ˵����Ϊ50������ԭ�ӽṹʾ��ͼΪ________________��
��2�� SnCl2��ĩ���Ũ��������ܽ⣬����ƽ���ƶ�ԭ������ԭ��____________��
SnCl4����������ˮ����Ũ��״�������������Ļ�����䷴Ӧ�Ļ�ѧ����ʽΪ______________��
��3����������(SnSO4)��һ����Ҫ�������Σ��㷺Ӧ���ڶ�����ҵ��ij�о�С�����SnSO4�Ʊ�·�����£�
�ٲ�������___________��
�ڼ���Sn�۵�������������a.������ҺpH�� b.__________.
�۷�Ӧ���õ�������SnO���õ��ó��������ӷ�Ӧ����ʽ��______________��
��4�����ۿ���������������������С��ͨ�����з����ⶨ�������۵Ĵ��ȣ����ʲ����뷴Ӧ����
�ٽ�1.2g�������������У������ķ�ӦΪ��Sn+2HCl=SnCl2+H2�����ڼ��������FeCl3������0.1 mol/L��K2Cr2O7�ζ����ɵ�Fe2+ (��֪���Ի����£�Cr2O72-�ɱ���ԭΪCr3+)������ȥK2Cr2O7��Һ32mL������������������������_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ֻ���¶��йص���
A.�ϳɰ���ҵ�У�������ת����B.�����Ƶ�ˮ��̶�
C.ˮ�����ӻ�D.�������ܽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�ͭ�ڹ�ũҵ�����о�����Ҫ����;��ij��ѧ��ȤС�������ͼ��ʾװ�ã���CuCl2��2H2O�����SOCl2��ȡ��ˮCuCl2�����չ�����SOCl2����֪��SOCl2���۵�Ϊ-105�����е�Ϊ76������ˮ����ˮ�����������������塣�ش��������⣺
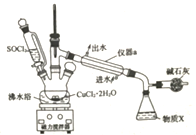
��1���ڿ�����ֱ�Ӽ���CuCl2��2H2O����ò�����������ˮCuCl2��ԭ����___________________���û�ѧ����ʽ��ʾ����
��2������a��������____________����ƿ�еõ�������x�Ļ�ѧʽΪ______________��
��3����ʯ���к���CaO��NaOH��NaOH�ĵ���ʽΪ__________����ʯ�ҵ�������______________��
��4��������ƿ��CuCl2��2H2O��SOCl2������Ӧ�Ļ�ѧ����ʽ��_______________________��
��5��ijͬѧ������ӵ��������ⶨ��ˮCuCl2��Ʒ��ͭԪ�صİٷֺ������������£�ȡ 0.2800 g��������ˮ���������KI���壬��ַ�Ӧ�����ɰ�ɫCuI���������뼸�ε�����Һ��ָʾ������0.1000 mol��L-1Na2S2O3����Һ�ζ�������ζ��յ�ʱ������Na2S2O3����Һ20.00mL���ζ���ӦΪI2+2S2O32-=S4O42-+2I-����
���ζ����յ�ʱ��������_____________________________________��
����������ͭԪ�صİٷֺ���Ϊ__________ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com