
【题目】某有机物结构简式为 ![]() ,下列叙述错误的是( )
,下列叙述错误的是( )
A.1mol该有机物在加热和催化剂作用下,最多能和4 mol H2反应
B.该有机物能使溴水褪色,也能使酸性KMnO4溶液褪色
C.该有机物遇硝酸银溶液产生白色沉淀
D.该有机物在一定条件下能发生消去反应和取代反应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列反应中,不属于氧化还原反应的是(反应条件未给出)( )
A. Fe2O3 + 3CO = 2Fe +3CO2 B. 4NH3 + 5O2 = 4NO + 6H2O
C. 2HClO = 2HCl + O2↑ D. IBr+H2O==HIO+HBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的分子式为C9H10O2 , 其核磁共振氢谱有5个峰,面积之比为1:2:2:2:3,红外光谱如图: 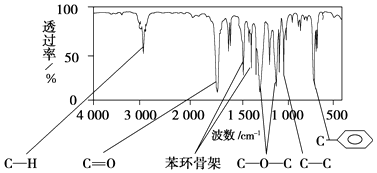
已知,A分子中只含一个苯环,且苯环上只有一个取代基,A与NaOH溶液共热的两种生成物均可用于食品工业(常见防腐剂和饮品),试填空.
(1)A的结构简式为 .
(2)A的分子结构中只含一个甲基的依据是(填序号). a.A的相对分子质量 b.A的分子式
c.A的核磁共振氢谱图 d.分子的红外光谱图
(3)A的芳香类同分异构体有多种,其中符合下列条件:①分子结构中只含一个官能团;②分子结构中含有一个甲基;③苯环上只有一个取代基,则A的芳香类同分异构体共有种(不包括A本身),其中水解产物能使FeCl3溶液变紫色的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表为元素周期表的一部分:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | ||
二 | C | N | ① | |||||
三 | ② | ③ | ④ | P | ⑤ | ⑥ |
请填写下列空白:
(1)表中元素,原子半径最大的是(填写元素符号);①的核外电子排布式;③和⑥两元素形成化合物的电子式为 .
(2)②③④三种元素最高价氧化物对应的水化物中,碱性最强的是(填化学式).
(3)比较④、⑤两种元素的简单离子半径:>(填离子符号);元素④最高价氧化物对应的水化物与硝酸反应的离子方程式为 .
(4)列举一个事实来证明元素①比元素⑤的非金属性强
(5)若8g甲烷气体完全燃烧生成液态水时放出445.15kJ的热量,请写出其热化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表中烃的分子式排列,判断空格中烃的同分异构体数目是( )
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
A.3
B.4
C.5
D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜溶液中含有少量氯化铁杂质,若要制得纯净的氯化铜,向溶液中加入下列试剂,不能达到目的是( )
A.NaOH
B.CuO
C.Cu(OH)2
D.Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3﹣对甲苯丙烯酸甲酯(E)是一种用于合成抗血栓药的中间体,其合成路线如下: ![]() +CO
+CO ![]()

![]() B
B ![]()

![]() E
E
已知:HCHO+CH3CHO ![]() CH2═CHCHO+H2O
CH2═CHCHO+H2O
(1)A中官能团的名称为 , A分子中核磁共振氢谱各峰值比为
(2)物质B的结构简式为 , 生成E的反应类型为
(3)试剂C可选用下列中的 . a.溴水 b.银氨溶液 c.酸性KMnO4溶液 d.新制Cu(OH)2悬浊液
(4)![]() 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为 .
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为 .
(5)遇FeCl3溶液呈紫色,且苯环上有两个取代基的A的同分异构体有种,E在一定条件下可以生成高聚物F,F的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定. Ⅰ.制备Na2S2O35H2O
反应原理:Na2SO3(aq)+S(s) ![]() Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80mL蒸馏水.另取5g研细的硫粉,用3mL乙醇润湿,加入上述溶液中.
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60分钟.
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O35H2O,经过滤、洗涤、干燥,得到产品.
回答问题: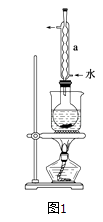
(1)硫粉在反应前用乙醇润湿的目的是 .
(2)仪器a的名称是 , 其作用是 .
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是 . 检验是否存在该杂质的方法是 .
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因: .
(5)Ⅱ.测定产品纯度 准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0molL﹣1碘的标准溶液滴定.
反应原理为2S2O ![]() +I2═S4O
+I2═S4O ![]() +2I﹣
+2I﹣
滴定至终点时,溶液颜色的变化:
(6)测定起始和终点的液面位置如图2,则消耗碘的标准溶液体积为mL.产品的纯度为(设Na2S2O35H2O相对分子质量为M) . 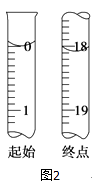
(7)Ⅲ.Na2S2O3的应用 Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO ![]() ,常用作脱氯剂,该反应的离子方程式为
,常用作脱氯剂,该反应的离子方程式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com